DNA-Stränge können miteinander interagieren und die berühmte Doppelhelix (Duplex) bilden, während RNA-Stränge eher dazu neigen, in sich selbst zu interagieren und so Haarnadeln, Schleifen, Kreuze usw. zu bilden. Alle diese Wechselwirkungen, sowohl zwischen Ketten als auch innerhalb einer Kette von Nukleinsäuren (NAs), sind auf die spezifische Bildung von Wasserstoffbrückenbindungen zwischen verschiedenen heterozyklischen Basen zurückzuführen. An der Bildung von Wasserstoffbrückenbindungen sind die Wasserstoffatome von Wasserstoffbrückenbindungsdonorgruppen und die Atome von Akzeptorgruppen beteiligt, die ein freies Elektronenpaar tragen. Die Energie dieser nichtkovalenten Bindung ist sehr niedrig, d.h. Die Verbindung ist schwach, aber da viele davon gebildet werden, ist die NC-Struktur insgesamt recht stabil. Es gibt die stabilsten Kombinationen paarweise interagierender Basen „Purin – Pyrimidin“: Adenin bindet an Thymin oder Uracil und Guanin an Cytosin. Solche Paarungen werden als kanonisch bezeichnet und kommen in der Natur (insbesondere bei DNA) am häufigsten vor.
In der modernen belebten Natur übernimmt die DNA die Funktion, die genetischen Informationen des Organismus zu speichern. Die Gesamtheit aller DNA-Moleküle bildet das Genom eines Organismus. Dies kann auf die Tatsache zurückzuführen sein, dass DNA-Moleküle chemisch stabiler und konformativ weniger mobil sind als RNA-Moleküle. RNA ist am Prozess der Umsetzung genetischer Informationen beteiligt; außerdem weist RNA eine ausgeprägte enzymatische Aktivität auf, d. h. die Fähigkeit, biochemische Reaktionen zu beschleunigen und zu steuern. Es kann jedoch davon ausgegangen werden, dass DNA-Moleküle im Laufe der Evolution zu einem Speicher für genetische Informationen wurden und in den frühen Stadien der Entstehung und Entwicklung des Lebens das Genom aus mobileren und aktiveren RNA-Molekülen gebildet wurde. RNA-Genome gibt es in der modernen Welt, aber nur in „halblebenden“ Lebewesen wie Viren.
Proteine in Zellen erfüllen vielfältige Funktionen: Transport, Strukturbildung, Schutz, Motor, Speicherung und Katalyse. Proteine bestehen wie NK aus Monomereinheiten – Aminosäuren (AA) (Abb. 4). In der Natur enthalten Proteine 21 Aminosäuren, die meist alle linkshändig sind (L-Isomere), also Drehen Sie den Polarisationswinkel von linear polarisiertem Licht beim Durchgang durch die AA-Lösung nach links. Proteine werden während der Translation mit Hilfe von Ribosomen, sehr komplexen RNA-Protein-Komplexen, synthetisiert, und die Matrix, die die Reihenfolge der Aminosäuren im synthetisierten Protein bestimmt, ist das RNA-Molekül. Der Aufbau einer Polypeptidkette (Proteinkette) erfolgt durch die Bildung von Peptidbindungen zwischen AK-Molekülen (Abb. 5). Proteine bilden abhängig von der Reihenfolge der AAs in ihrer Zusammensetzung komplexe räumliche Strukturen, die ihren zellulären Funktionen entsprechen. Für uns ist es wichtig, dass Proteine sowohl am Replikationsprozess als auch am Translationsprozess in modernen Organismen direkt beteiligt sind und ihre enzymatische Funktion realisieren.
Im Allgemeinen kann das allgemeine Erscheinungsbild des Prozesses der Reproduktion und Umsetzung genetischer Informationen in den meisten lebenden Organismen als eine Triade aufeinanderfolgender Reaktionen dargestellt werden:
- Reproduzieren. Synthese von Tochter-DNA auf einer DNA-Matrize;
- Transkription. RNA-Synthese auf einer DNA-Matrize;
- Übertragen. Proteinsynthese auf einer RNA-Matrize.
Allerdings ist es, wie bereits erwähnt, durchaus möglich, dass ein Organismus auch ohne DNA funktioniert. Sein Genom liegt in diesem Fall in Form von RNA vor und die Prozesse der Transkription und Translation fallen zusammen. Dieses Phänomen wird im Abschnitt zur „RNA-Welt“-Theorie ausführlicher besprochen.
Geschichte der Theorien über die Entstehung des Lebens
Seit Jahrtausenden versucht die Menschheit eine Antwort auf die Frage zu finden, wie das Leben entstanden ist. Zu verschiedenen Zeiten wurden unterschiedliche Erklärungen für dieses Phänomen gegeben. Wir wenden uns den bedeutendsten dieser Theorien zu, die man korrekter als Hypothesen bezeichnen würde.
Steady-State-Theorie.
Nach dieser Hypothese existierte die Erde für immer, ist nie entstanden, war immer in der Lage, Leben zu beherbergen, und alle Veränderungen auf ihr waren völlig unbedeutend. Auch Arten lebender Organismen gab es schon immer, und für jede Art gibt es nur zwei Möglichkeiten – eine Veränderung der Zahl oder das Aussterben. Es ist klar, dass diese „Theorie“ derzeit der Kritik einfach nicht standhält.
Theorie der spontanen Erzeugung.
Die Theorie ist sehr alt und in China, Ägypten und Babylon weit verbreitet. In Griechenland fand es Ausdruck in der Lehre des Empedokles über die organische Evolution. Auch Aristoteles hielt daran fest. Ihm zufolge enthalten bestimmte Partikel eines Stoffes einen „Wirkstoff“, der unter geeigneten Bedingungen einen lebenden Organismus entstehen lassen kann. Dieser „Anfang“ findet sich laut Aristoteles in einem befruchteten Ei, verrottendem Fleisch, Schlamm und Sonnenlicht:
„Das sind die Fakten – Lebewesen können nicht nur durch die Paarung von Tieren entstehen, sondern auch durch die Zersetzung des Bodens... Manche Pflanzen entwickeln sich aus Samen, andere entstehen spontan unter dem Einfluss der Naturgewalten verrottende Erde oder bestimmte Pflanzenteile ...“
Mit dem Aufkommen des Christentums, insbesondere im Mittelalter, geriet die Theorie der spontanen Zeugung jedoch unter das Joch der Kirche. Sie galt als Attribut der Hexerei und als Manifestation des Teufels. Dennoch existierte sie weiter. An der Wende vom 16. zum 17. Jahrhundert. Van Helmont beschrieb ein Experiment, bei dem es ihm gelang, Mäuse aus schmutziger Wäsche und Weizen zu gewinnen, die in einem dunklen Schrank aufbewahrt wurden. Van Helmont betrachtete den menschlichen Schweiß als die aktive Quelle der Mausentwicklung. Ende des 17. Jahrhunderts führte der Italiener Francesco Redi ein strengeres Experiment durch: Fleisch, Fisch und Schlangen wurden in Gefäße gelegt, einige der Gefäße wurden versiegelt, andere blieben offen. Es stellte sich heraus, dass in den verschlossenen Gefäßen keine Keimbildung stattfand, in den offenen Gefäßen hingegen Fliegenlarven. Aus diesem Redi wurde geschlossen, dass Lebewesen nur aus bereits existierendem Leben entstehen.
Im Jahr 1765 kochte Lazzardo Spallanzani Fleisch- und Gemüsezubereitungen und versiegelte sie sofort. Einige Tage später untersuchte er die Abkochungen und fand keine Lebenszeichen. Daraus schloss er, dass die hohe Temperatur alles Lebewesen zerstörte und nichts Neues entstehen konnte. Die Theorie der spontanen Erzeugung wurde schließlich in den Experimenten von Louis Pasteur widerlegt, der die Gültigkeit der Theorie der Biogenese bewies, d. h. der Ursprung des Lebens aus dem vorherigen Leben. Dies warf zwar die schwierige Frage nach der Herkunft des allerersten lebenden Organismus auf.
Die Theorie des Kreationismus.
Nach dieser Theorie entstand das Leben als Ergebnis eines übernatürlichen Ereignisses in der Vergangenheit, wobei es sich in den meisten Fällen um eine göttliche Schöpfung handelt. Im Jahr 1650 berechnete der irische Bischof Ussher, dass die Erde im Oktober 4004 v. Chr. entstand. Es gibt viele andere ähnliche „Berechnungen“.
Panspermie-Theorie.
Diese Theorie schlägt keinen Mechanismus für die Entstehung des Lebens vor, sondern stellt lediglich ein Postulat über seinen außerirdischen Ursprung auf. Es wird argumentiert, dass Leben wiederholt zu unterschiedlichen Zeiten und an verschiedenen Orten im Universum entstehen könnte. Bei der Untersuchung von Meteoritenmaterialien wurden tatsächlich einige Substanzen entdeckt – Vorläufer von Lebewesen sowie Strukturen, die einfachen Mikroorganismen ähneln. Sie könnten wahrscheinlich eine Rolle bei der Entstehung oder Vielfalt des irdischen Lebens gespielt haben. Auf dieses Thema gehen wir im letzten, vierten Abschnitt dieses Artikels näher ein.
Theorie der biochemischen Evolution.
Historisch gesehen ist diese Theorie mit dem Namen des bemerkenswerten russischen Wissenschaftlers A.I. verbunden. Oparin, der die Meinung vertrat, dass unter den Bedingungen der Primäratmosphäre der Erde, die sich erheblich von den gegenwärtigen unterscheiden, die Synthese aller für die Entstehung des Lebens notwendigen Vorläufersubstanzen hätte stattfinden können. Es wird angenommen, dass die Uratmosphäre hauptsächlich aus Ammoniak, Wasser, Methan, Kohlenmonoxid und Kohlendioxid bestand. Die Abwesenheit von Sauerstoff verlieh ihm regenerierende Eigenschaften. Unter solchen Bedingungen könnten organische Substanzen viel leichter entstehen und über längere Zeit ohne Zerfall konserviert werden. Oparin glaubte, dass unter Meeresbedingungen komplexe Substanzen aus einfacheren synthetisiert werden könnten. Die für Reaktionen benötigte Energie wurde durch Sonnenstrahlung gebracht, weil den schützenden Ozonschild gab es noch nicht; Die Synthese fand auch unter Bedingungen von Blitzentladungen statt. Die Vielfalt der im Ozean gefundenen einfachen Verbindungen und die großen Zeitskalen lassen darauf schließen, dass sich im Ozean eine große Menge organischer Materie ansammelt, die die „Primärbrühe“ bildet, aus der das Leben hätte entstehen können. Diese Theorie wurde in den Experimenten von Stanley Miller aus dem Jahr 1953 hervorragend bestätigt: Starke elektrische Entladungen wurden durch ein Gasgemisch geleitet, das die Primäratmosphäre simulierte. Dadurch war es möglich, eine Reihe von AKs, Adenin, Ribose und anderen einfachen Zuckern zu synthetisieren. In einem ähnlichen Experiment erhielt Orgel kurze NAs (Oligonukleotide). Als Ergebnis dieser Studien wurde klar, dass die wichtigsten organischen Substanzen-Monomere, die für die Entstehung von Polymermolekülen von NA und Proteinen notwendig sind, tatsächlich unter den Bedingungen der präbiotischen Welt, d. h. chemisch gewonnen werden konnten. eine Welt, in der es immer noch kein Leben gibt. Aber Oparins Theorie lässt die Hauptfrage – den Mechanismus des Übergangs vom Unbelebten zum Lebendigen – noch offen. So soll es aussehen. Die Hauptrolle spielten Proteine – sie bildeten kolloidale hydrophile Komplexe mit den Molekülen des umgebenden Wassers. Diese Komplexe bildeten einzigartige Mizellen. Die Verschmelzung solcher Komplexe untereinander führte zu ihrer Trennung von der aquatischen Umwelt, was als Koazervation bezeichnet wurde. Koazervattröpfchen könnten Stoffe mit der Umgebung austauschen und verschiedene Verbindungen anreichern. Die Unterschiede in der Koazervatzusammensetzung boten Möglichkeiten für eine biochemische natürliche Selektion. In den Tropfen selbst fanden weitere chemische Umwandlungen der dort gelangten Stoffe statt. An der Grenze der Tröpfchen zur äußeren Umgebung reihten sich Fettmoleküle (Lipide) aneinander und bildeten eine primitive Membran, die die Stabilität des gesamten Systems erhöhte. Als sich innerhalb des Koazervats das erste Molekül bildete, das auf die eine oder andere Weise zur Selbstreproduktion fähig war, entstand die erste zellartige Struktur. Eine Vergrößerung der Koazervate und deren Teilung, noch statistisch, könnte zur Bildung identischer Kopien von Koazervaten führen. Sie absorbierten auch Umweltbestandteile und der Prozess ging weiter. Auf diese Weise könnte der erste heterotrophe Organismus entstanden sein, der die organischen Substanzen der „Primärbrühe“ zur Ernährung nutzte.
Fred Hoyle wies auf die geringe Wahrscheinlichkeit hin, dass all diese Prozesse in einer derart komplexen und gezielten Reihenfolge ablaufen, und sagte, diese Theorie sei „genauso lächerlich wie die Idee, dass eine Boeing 747 durch einen Hurrikan zusammengebaut werden könnte, der über eine Mülldeponie zieht.“ Tatsächlich sind diese Ereignisse unwahrscheinlich, wenn wir sie isoliert voneinander und als voneinander unabhängig betrachten. Neuere Studien zeigen jedoch, dass dieser Ansatz nicht korrekt ist und in komplexen multimolekularen Systemen viele Prozesse synergistisch bestimmt sind. In diesem Fall wird die Bildung eines lebenden Organismus nach Ablauf eines bestimmten Stadiums unvermeidlich.
Die Theorie der „RNA-Welt“
In den letzten Jahren hat diese Theorie über den Ursprung des Lebens immer mehr Anhänger gefunden und ist bei der Lösung dieses Problems dominant geworden. Sein Wesen liegt darin, dass die Begründer des Lebens keine Proteine, sondern RNA-Moleküle waren. Die Bildung der Bestandteile von RNA-Monomereinheiten – Ribose-Kohlenhydrat-Zyklen und heterozyklische Basen – bereitete, wie bereits gezeigt, keine grundsätzlichen Schwierigkeiten. Es ist viel schwieriger, sich den Prozess der Bildung von Nukleosiden direkt aus ihnen und dann deren Kombination zu NCs vorzustellen. Tatsächlich könnte sich eine solche Synthese unter den Bedingungen eines Homophasenprozesses in einem gasförmigen oder flüssigen Medium als äußerst schwierig erweisen. Allerdings ist die Durchführung unter Heterophasenkatalyse auf einem festen Träger relativ einfach. Letztere sind viele Mineralien der Erdkruste: Calciumcarbonat, Kaolinit, Montmorillonit, Aluminiumverbindungen, Zeolithe. Gleichzeitig tragen sie nicht nur zur Beschleunigung der Synthese, sondern auch zur richtigen Ausrichtung der reagierenden Komponenten bei. Auf solchen Substraten wurde zunächst die Vernetzung von Nukleosiden und dann die Bildung einer Internukleotidbindung unter Beteiligung von Phosphorsäure oder ihren Derivaten durchgeführt. Beispielsweise gelang die Synthese von Oligocytidin, also ein kurzes RNA-Molekül, das nur aus einem Nukleosidtyp besteht, auf einem Montmorillonit-Träger aus 5"-Phosphorimidazolid-Cytidin. In ähnlicher Weise wurden komplexere Oligonukleotide erhalten, die Nukleoside verschiedener Typen enthielten. Interessanterweise blieb die RNA-Kette sehr lange stabil. Gleichzeitig könnten lange Oligonukleotide, die sich auf einer mineralischen Matrix befinden, an Di- und Trinukleotide binden, indem sie Wasserstoffbrückenbindungen zwischen komplementären Basen bilden. Zwischen diesen Di- und Trinukleotiden könnten auch Internukleotidbindungen gebildet werden. Auf diese Weise erfolgt die Synthese von Tochter-RNA wurde an der RNA-Matrix durchgeführt, also ein Analogon der Transkription. Eine ähnliche Abfolge von Operationen könnte auch bei der templatgesteuerten Synthese von Peptiden auf RNA ablaufen: Einzelne Di- und Trinukleotide wurden beispielsweise mit AK-Molekülen assoziiert, aufgrund hydrophober Wechselwirkungen oder Wasserstoffbrückenbindungen und übertrug sie auf die RNA-Matrix. Trinukleotide interagierten über Wasserstoffbrückenbindungen, was zur Bildung von Nukleotiden führte, die AKs in der Nähe der RNA-Kette tragen. Wenn sie nahe beieinander lagen, wurde die Bildung von Peptidbindungen zwischen AK-Molekülen durch die Bildung eines Polypeptids – eines kleinen „Proteins“ – möglich. Auf diese Weise wurde die Translationsreaktion ohne Beteiligung von Enzymproteinen realisiert. Besonders hervorzuheben ist hier, dass alle diese Prozesse auf eine sehr spezifische Weise durchgeführt wurden, denn Die Bildung von Wasserstoffbrückenbindungen zwischen verschiedenen Molekülen ist recht selektiv: Die Wechselwirkungen, bei denen die meisten Wasserstoffbrückenbindungen realisiert werden, sind am stabilsten. Unter Bedingungen des Gleichgewichts der Prozesse führte diese Selektivität zur Reproduktion bestimmter Moleküle: Jede Matrix „produzierte“ Produkte, die für sie einzigartig waren. Eine solche Synthese könnte in primären Koazervattröpfchen stattfinden. Dies führte zur Anhäufung einer klar definierten Gruppe von Biomolekülen in jedem von ihnen, aber die Vielfalt der Tröpfchen selbst und die Bedingungen, unter denen sie existierten, boten große Möglichkeiten für die Auswahl der stabilsten Tröpfchen, was bereits eine Protoevolution war. Die Tröpfchen, die sich durch Teilung selbst reproduzierten, wuchsen an Größe und wurden immer komplexer und enthielten immer mehr Substanzen. Auf diese Weise könnte die erste Zelle entstanden sein.
Es ist jedoch unklar, ob RNA das erste lebensbildende Molekül war oder ob es ältere Vorgänger gab. Vor einiger Zeit wurde eine chimäre Substanz namens Peptidnukleinsäure (PNA) synthetisiert, bei der das Rückgrat der Kette aus Molekülen der Aminosäure N-(2-Aminoethyl)glycin bestand und an dieses Rückgrat heterozyklische Basen gebunden waren . Daher wurde das Zucker-Phosphat-Rückgrat durch ein Polypeptid-Rückgrat ersetzt. Derzeit betrachten einige Forscher PNA als einen Kandidaten für die Rolle eines möglichen RNA-Vorläufers, obwohl die präbiotische Rolle von PNA noch nicht schlüssig nachgewiesen wurde.
Weltraumursprünge und Weltraumtransport
Mit der Entwicklung spektraler Methoden zur Untersuchung des Weltraums wurden neue interessante Fakten gewonnen, die für die Möglichkeit der Entstehung von Leben außerhalb der Erde und seiner anschließenden Einführung auf unseren Planeten durch Meteoriten oder andere Transportmittel sprechen.
Es wurde bereits früher entdeckt, dass viele Meteoriten eine Vielzahl von Chemikalien enthalten, die als Vorläufer für Leben dienen. Besonderes Augenmerk galt dabei den kohligen Chondriten, in denen Strukturen gefunden wurden, die den primären Protozoen ähneln. Obwohl die biologische Vergangenheit dieser Einschlüsse noch nicht bestätigt ist, entwickelt sich die Theorie ihres biologischen Ursprungs rasch weiter und es werden weiterhin neue Daten über die Entdeckung ähnlicher Formationen in Meteoriten eingehen, die insbesondere im Unterland gefunden wurden Schichten des kontinentalen Gletschers der Antarktis.
Wir verfügen nun über Daten, die auf das Vorhandensein erheblicher Mengen organischer Materie in interstellaren Gas- und Staubwolken hinweisen. Wenn man bedenkt, dass dichte und diffuse Wolken 20–30 % der gesamten galaktischen Materie ausmachen, wird das Ausmaß, in dem organische Synthese im interstellaren Raum stattfindet, deutlich. Es wurden mehr als 130 organische Verbindungen entdeckt, darunter Formaldehyd, Cyanacetylen, Ameisensäure, Wasser, Ammoniak, d. h. notwendige Vorläufer von Biomolekülen. Das Vorhandensein von Phosphor wurde nachgewiesen; aromatische Kohlenwasserstoffe kommen mit hoher Wahrscheinlichkeit in diffusen Wolken vor; Fullerene, Kohlenstoffketten und kerogenähnliche Strukturen mit komplexer Geometrie wurden entdeckt. Es ist interessant festzustellen, dass die Konzentration der Hauptelemente, die an der Bildung von Biomolekülen beteiligt sind, C, N, S, P, O, H, im Allgemeinen der durchschnittlichen Konzentration dieser Elemente im Weltraum entspricht. Es ist bekannt, dass kosmischer Staub ständig von der Erde eingefangen wird (zig Tonnen pro Tag). Dieser Prozess, der sicherlich unter den Bedingungen der Urerde ablief, könnte dazu dienen, organische Substanzen an die Oberfläche des Planeten zu bringen, wo sie unter milderen Bedingungen, beispielsweise im Meerwasser, weitere Umwandlungen erfahren könnten.
Von großem Interesse ist der Prozess der Synthese organischer Verbindungen auf der Oberfläche fester Gas- und Staubwolkenpartikel. Es wird angenommen, dass sie auf amorphen Silikaten mit einer Beimischung von Metalloxiden und Sulfiden (Al, Fe, Mg) sowie Olivin - gemischtem Eisen- und Magnesiumsulfat - basieren. All dies bildet den Kern des Partikels, der von einem eisigen Mantel bedeckt ist und Wasser, Kohlenstoffoxide und viele einfache organische Verbindungen enthält. Es ist klar, dass unter Bedingungen von Nulltemperaturen nur Reaktionen mit einer Aktivierungsenergie nahe Null möglich sind; es können auch Prozesse ablaufen, an denen ein mobiles Proton beteiligt ist, das in der Lage ist, durch die Aktivierungsbarriere zu tunneln. Dabei ist auch zu berücksichtigen, dass aufgrund der geringen Konzentration des Stoffes nur binäre Wechselwirkungen auftreten. Wenn jedoch ein Teilchen aus der stationären Phase in eine wärmere aktive Sternentstehungsregion eintritt, werden Prozesse aktiviert, die durch Bombardierung mit kosmischen Strahlen, UV-Strahlung und Temperaturänderungen verursacht werden. Als Eisanaloga ähnlichen Stoffen ausgesetzt wurden, wurden komplexe Mischungen von Radikalen und Substanzen, einschließlich komplexer stabiler organischer Verbindungen, entdeckt. Es ist davon auszugehen, dass die dazu führenden chemischen Nichtgleichgewichtsprozesse komplexerer Natur sind als gewöhnliche Prozesse unter Erdbedingungen.
Es sollte auch beachtet werden, dass die Entstehung und Entwicklung von Leben außerhalb der Erde mehrere Wege verfolgen kann. Erstens ist ein „erdähnlicher“ Weg möglich, d.h. die Entstehung biologischer Moleküle, die terrestrischen NKs und Proteinen ähneln, das Vorhandensein von Genen sowie die Speicherung und Übertragung genetischer Informationen durch einen Mechanismus, der dem der Erde ähnelt. Zweitens können wir von der Existenz einer „Spiegelwelt“ ausgehen, d.h. Welt bestehend aus D-Aminosäuren und L-Nukleosiden. Darüber hinaus sind diese Verbindungen auch auf der Erde nicht völlig exotisch. D-Aminosäuren sind Teil der Neuropeptide und Opioidpeptide einiger höherer Organismen und bei niederen Organismen Teil der Zellwand. Kurze NAs, die aus L-Nukleosiden bestehen, wurden chemisch synthetisiert und es wurde gezeigt, dass sie nicht mit herkömmlichen D-Nukleinsäuren interagieren, aber mit L-Oligonukleotiden stabile Duplexe bilden können. Schließlich kann nicht ausgeschlossen werden, dass biologische Moleküle und die Mechanismen ihrer Funktionsweise unter Bedingungen, die sich stark von denen auf der Erde unterscheiden, völlig anders sein können. Beispielsweise ist es theoretisch möglich, die Entstehung von Biomolekülen anzunehmen, die Siliziumatome anstelle von Kohlenstoffatomen enthalten. Es ist klar, dass die Molekülmasse solcher Moleküle deutlich höher sein wird als die Masse herkömmlicher kohlenstoffhaltiger Analoga, was die Mobilität der aus ihnen bestehenden Organismen erheblich einschränken und die Entwicklungswege solcher „lebenden Steine“ verändern dürfte.
Die RNA-Welt ist ein hypothetisches Stadium in der Entstehung des Lebens auf der Erde, als Ensembles von Ribonukleinsäuremolekülen sowohl die Funktion der Speicherung genetischer Informationen als auch der Katalyse chemischer Reaktionen erfüllten. Anschließend entstand aus ihren Assoziationen modernes DNA-RNA-Protein-Leben, isoliert durch eine Membran von der äußeren Umgebung. Die Idee einer RNA-Welt wurde erstmals 1968 von Carl Woese vorgeschlagen, später von Leslie Orgel weiterentwickelt und schließlich 1986 von Walter Gilbert formuliert.
Zusammenfassung
In lebenden Organismen laufen fast alle Prozesse hauptsächlich durch Proteinenzyme ab. Proteine können sich jedoch nicht selbst replizieren und werden in der Zelle auf der Grundlage der in der DNA enthaltenen Informationen de novo synthetisiert. Die DNA-Verdoppelung erfolgt jedoch nur aufgrund der Beteiligung von Proteinen und RNA. Es entsteht ein Teufelskreis, aufgrund dessen im Rahmen der Theorie der spontanen Lebensentstehung die Notwendigkeit nicht nur der abiogenen Synthese beider Molekülklassen, sondern auch der spontanen Entstehung eines Komplexes erkannt werden musste System ihrer Wechselbeziehung.
Anfang der 1980er Jahre wurde die katalytische Fähigkeit von RNA im Labor von T. Check und S. Altman in den USA entdeckt. In Analogie zu Enzymen wurden RNA-Katalysatoren Ribozyme genannt, und Thomas Check wurde für ihre Entdeckung 1989 mit dem Nobelpreis für Chemie ausgezeichnet. Darüber hinaus stellte sich heraus, dass das aktive Zentrum der Ribosomen eine große Menge an rRNA enthält. RNA ist auch in der Lage, einen Doppelstrang zu bilden und sich selbst zu replizieren.
Somit könnte RNA völlig autonom existieren und „metabolische“ Reaktionen katalysieren, beispielsweise die Synthese neuer Ribonukleotide und sich selbst reproduzieren, wobei die katalytischen Eigenschaften von „Generation“ zu „Generation“ erhalten bleiben. Die Anhäufung zufälliger Mutationen führte zum Auftreten von RNAs, die die Synthese bestimmter Proteine katalysieren, die wirksamere Katalysatoren sind, und daher wurden diese Mutationen während der natürlichen Selektion fixiert. Andererseits entstanden spezialisierte Speicher für genetische Informationen – die DNA. RNA blieb als Vermittler zwischen ihnen.
Die Rolle der RNA in der modernen Welt
Spuren der RNA-Welt verbleiben in modernen lebenden Zellen, und RNA ist an entscheidenden Prozessen des Zelllebens beteiligt:
1) Der Hauptenergieträger in Zellen – ATP – ist ein Ribonukleotid, kein Desoxyribonukleotid.
2) Die Proteinbiosynthese erfolgt fast ausschließlich unter Verwendung verschiedener RNA-Typen:
· Messenger-RNAs sind die Vorlage für die Proteinsynthese in Ribosomen;
· Transfer-RNAs liefern Aminosäuren an Ribosomen und implementieren den genetischen Code;
· Ribosomale RNA stellt das aktive Zentrum der Ribosomen dar und katalysiert die Bildung von Peptidbindungen zwischen Aminosäuren.
3) RNA ist auch für die DNA-Replikation von entscheidender Bedeutung:
· Um den Prozess der DNA-Vervielfältigung zu starten, ist ein RNA-Seeder (Primer) erforderlich.
· Für die endlose Verdoppelung der DNA, die nicht durch die Hayflick-Grenze begrenzt ist, werden in eukaryotischen Zellen die Endabschnitte der Chromosomen (Telomere) durch das Enzym Telomerase, das eine RNA-Matrize enthält, ständig wiederhergestellt.
4) Beim Prozess der reversen Transkription werden Informationen aus der RNA in DNA umgeschrieben.
5) Während des Prozesses der RNA-Reifung werden verschiedene RNAs verwendet, die keine Proteine kodieren, darunter kleine nukleäre RNAs und kleine nukleoläre RNAs.
Darüber hinaus speichern viele Viren ihr genetisches Material in Form von RNA und stellen der infizierten Zelle eine RNA-abhängige RNA-Polymerase für deren Replikation zur Verfügung.
Abiogene RNA-Synthese
Die abiogene Synthese von RNA aus einfacheren Verbindungen wurde experimentell nicht vollständig nachgewiesen. 1975 zeigten Manfred Samper und Rüdiger Lews in Eigens Labor, dass in einer Mischung, die überhaupt keine RNA, sondern nur Nukleotide und Qβ-Replikase enthielt, unter bestimmten Bedingungen spontan selbstreplizierende RNA entstehen konnte.
Im Jahr 2009 gelang es einer Gruppe von Wissenschaftlern der Universität Manchester unter der Leitung von John Sutherland, die Möglichkeit der Synthese von Uridin und Cytidin mit hoher Effizienz und den Grad der Konsolidierung des Reaktionsergebnisses (sowie die Möglichkeit der Akkumulation von Endprodukten) zu demonstrieren Produkte) unter den Bedingungen der frühen Erde. Obwohl die abiogene Synthese von Purinbasen schon vor längerer Zeit nachgewiesen wurde (insbesondere Adenin ist ein Pentamer der Blausäure), wurde ihre Glykosylierung mit freier Ribose von Adenosin und Guanosin bisher nur in einem nachgewiesen ineffektive Weise.
Evolution der RNA
Die Fähigkeit von RNA-Molekülen, sich weiterzuentwickeln, wurde in einer Reihe von Experimenten eindeutig nachgewiesen. Schon vor der Entdeckung der katalytischen Aktivität von RNA wurden solche Experimente von Leslie Orgel und Kollegen in Kalifornien durchgeführt. Sie fügten dem Reagenzglas ein Gift mit RNA hinzu – Ethidiumbromid, das die RNA-Synthese hemmt. Zunächst wurde die Syntheserate durch das Gift verlangsamt, doch nach etwa neun „Reagenzglasgenerationen“ der Evolution brachte der Prozess der natürlichen Selektion eine neue Art von RNA hervor, die gegen das Gift resistent war. Durch sukzessive Verdoppelung der Giftdosen wurde eine RNA-Art entwickelt, die gegen sehr hohe Konzentrationen resistent war. Insgesamt wechselten im Experiment 100 Reagenzglasgenerationen (und viele weitere RNA-Generationen, da sich auch innerhalb jedes Reagenzglases Generationen änderten). Obwohl in diesem Experiment die RNA-Replikase von den Experimentatoren selbst zur Lösung gegeben wurde, entdeckte Orgel, dass RNA auch ohne Zugabe eines Enzyms zur spontanen Selbstkopie fähig ist, wenn auch viel langsamer.
Ein zusätzliches Experiment wurde später im Labor der deutschen Schule von Manfred Eugen durchgeführt. Er entdeckte die spontane Entstehung eines RNA-Moleküls in einem Reagenzglas mit einem Substrat und einer RNA-Replikase. Es entstand durch eine schrittweise fortschreitende Evolution.
Nach der Entdeckung der katalytischen Aktivität von RNA (Ribozymen) wurde ihre Entwicklung in einem automatisierten, computergesteuerten Gerät 2008 in Experimenten von Brian Pegel und Gerald Joyce am Scripps Research Institute in Kalifornien beobachtet. Der Faktor, der die Rolle des Selektionsdrucks spielte, war das begrenzte Substrat, zu dem Oligonukleotide gehörten, die das Ribozym erkannte und an sich selbst anheftete, sowie Nukleotide für die Synthese von RNA und DNA. Beim Erstellen von Kopien kam es manchmal zu Defekten – Mutationen –, die ihre katalytische Aktivität beeinträchtigten (um den Prozess zu beschleunigen, wurde die Mischung mehrmals mithilfe einer Polymerase-Kettenreaktion mit „ungenauen“ Polymerasen mutiert). Auf dieser Grundlage erfolgte die Auswahl der Moleküle: Die Moleküle, die sich am schnellsten kopierten, begannen schnell in der Umgebung zu dominieren. Dann wurden 90 % der Mischung entfernt und stattdessen eine frische Mischung mit Substrat und Enzymen hinzugefügt und der Zyklus erneut wiederholt. Innerhalb von 3 Tagen erhöhte sich die katalytische Aktivität der Moleküle aufgrund von nur 11 Mutationen um das 90-fache.
Diese Experimente beweisen, dass die ersten RNA-Moleküle nicht über ausreichend gute katalytische Eigenschaften verfügen mussten. Sie entwickelten sich später im Laufe der Evolution unter dem Einfluss der natürlichen Selektion.
Im Jahr 2009 zeigten die kanadischen Biochemiker der Universität Montreal K. Bokov und S. Steinberg, nachdem sie den Hauptbestandteil des Ribosoms des Bakteriums Escherichia coli, das 23S-rRNA-Molekül, untersucht hatten, wie sich der Mechanismus der Proteinsynthese aus relativ kleinen und einfache Ribozyme. Das Molekül wurde in 60 relativ unabhängige Strukturblöcke unterteilt, von denen der wichtigste das katalytische Zentrum (Peptidyl-Transferase-Zentrum, PTC, Peptidyl-Transferase-Zentrum) ist, das für die Transpeptidierung (Bildung einer Peptidbindung) verantwortlich ist. Es wurde gezeigt, dass alle diese Blöcke nacheinander vom Molekül abgetrennt werden können, ohne den verbleibenden Teil zu zerstören, bis nur noch das Transpeptidierungszentrum übrig bleibt. Es behält jedoch die Fähigkeit, die Transpeptidierung zu katalysieren. Wenn jede Bindung zwischen den Blöcken eines Moleküls als Pfeil dargestellt wird, der von dem Block, der bei der Trennung nicht zerstört wird, zu dem Block zeigt, der zerstört wird, dann bilden solche Pfeile keinen einzigen geschlossenen Ring. Wenn die Richtung der Verbindungen zufällig wäre, wäre die Wahrscheinlichkeit dafür weniger als eins zu einer Milliarde. Diese Art der Verbindungen spiegelt somit die Abfolge der schrittweisen Hinzufügung von Blöcken während der Evolution des Moleküls wider, die die Forscher im Detail rekonstruieren konnten. Der Ursprung des Lebens könnte also ein relativ einfaches Ribozym gewesen sein – das PTC-Zentrum des 23S-rRNA-Moleküls, dem dann neue Blöcke hinzugefügt wurden, um den Prozess der Proteinsynthese zu verbessern. Der PTC selbst besteht aus zwei symmetrischen Klingen, von denen jede den CCA-Schwanz eines tRNA-Moleküls hält. Es wird angenommen, dass diese Struktur als Ergebnis der Duplikation (Verdoppelung) einer ursprünglichen Klinge entstanden ist. Funktionelle RNAs (Ribozyme), die zur Katalyse fähig sind Transpeptidierung wurden mithilfe der Methode der künstlichen Evolution erhalten. Die Struktur dieser künstlich gewonnenen Ribozyme kommt der Struktur des Protoribosoms sehr nahe, die die Autoren „berechnet“ haben.
Eigenschaften von Objekten in der RNA-Welt
Es gibt unterschiedliche Annahmen darüber, wie selbstreplizierende RNA-Systeme aussahen. Am häufigsten wird die Notwendigkeit von RNA-Aggregationsmembranen oder der Platzierung von RNA auf der Oberfläche von Mineralien und im Porenraum von Lockergesteinen postuliert. In den 1990er Jahren demonstrierten A. B. Chetverin und seine Kollegen die Fähigkeit von RNA, molekulare Kolonien auf Gelen und festen Substraten zu bilden, wenn Bedingungen für die Replikation geschaffen werden. Es kam zu einem freien Austausch von Molekülen, die bei einer Kollision Abschnitte austauschen konnten, wie experimentell gezeigt wurde. Dadurch entwickelte sich die gesamte Gruppe der Kolonien schnell.
Nach dem Aufkommen der Proteinsynthese entwickelten sich Kolonien, die Enzyme erzeugen konnten, erfolgreicher. Die Kolonien wurden sogar noch erfolgreicher, da sie einen zuverlässigeren Mechanismus zur Speicherung von Informationen in der DNA entwickelt hatten und schließlich durch eine Lipidmembran von der Außenwelt getrennt waren, die die Ausbreitung ihrer Moleküle verhinderte.
Prä-RNA-Welten
Der Biochemiker R. Shapiro kritisiert die RNA-Welthypothese und glaubt, dass die Wahrscheinlichkeit der spontanen Entstehung von RNA mit katalytischen Eigenschaften sehr gering sei. Anstelle der Hypothese „Am Anfang war die RNA“ schlägt er die Hypothese „Am Anfang war der Stoffwechsel“ vor, also die Entstehung von Komplexen chemischer Reaktionen – Analoga von Stoffwechselzyklen – unter Beteiligung niedermolekularer Verbindungen im Inneren auftretende Kompartimente – räumlich begrenzt durch spontan gebildete Membranen oder andere Phasengrenzen – Regionen. Dieses Konzept steht der von A. I. Oparin 1924 vorgeschlagenen Koazervathypothese der Abiogenese nahe.
Eine weitere Hypothese der abiogenen RNA-Synthese, die das Problem der geringen geschätzten Wahrscheinlichkeit der RNA-Synthese lösen soll, ist die 2004 vorgeschlagene Welthypothese der polyaromatischen Kohlenwasserstoffe, die die Synthese von RNA-Molekülen auf der Grundlage eines Stapels polyaromatischer Ringe vorschlägt.
Tatsächlich lehnen beide „Prä-RNA-Welten“-Hypothese die RNA-Welt-Hypothese nicht ab, sondern modifizieren sie, indem sie die anfängliche Synthese replizierender RNA-Makromoleküle in primären Stoffwechselkompartimenten oder auf der Oberfläche von Partnern postulieren, was die „RNA-Welt“ dazu drängt die zweite Stufe der Abiogenese.
Der Akademiker der Russischen Akademie der Wissenschaften A. S. Spirin glaubt, dass die RNA-Welt nicht auf der Erde entstanden sein und existiert haben kann, und erwägt die Möglichkeit eines außerirdischen (hauptsächlich auf Kometen) Ursprungs und einer außerirdischen Entwicklung der RNA-Welt.
Das zentrale Dogma der Biologie, das Francis Crick Ende der 1950er Jahre formulierte, wird in seiner klassischen Form untersucht: DNA → RNA → Protein. Es gibt jedoch genügend Daten, um das wörtliche Verständnis dieses Hauptprinzips des Lebens anzuzweifeln.
Aktuelles Beispiel: in der Juni-Publikation Wissenschaftliche Berichte Russische Wissenschaftler des Instituts für Bioorganische Chemie und des Föderalen Wissenschaftlichen und Klinischen Zentrums für Physikochemische Medizin haben gezeigt, dass die Vielfalt der Proteinisoformen in Zellen deutlich geringer ist als theoretisch möglich. Journalisten beeilten sich zu berichten, dass sich die Vorstellung vom zentralen Dogma der Molekularbiologie verändert. Allerdings verändert sich das Dogma seit 70 Jahren, da es ursprünglich nur eine Hypothese war. Schöpfer Crick nannte es das Wort „Dogma“, weil ihm dieses Wort gefiel! Wichtig ist noch etwas anderes: Wie und warum sich die Haupthypothese der Molekularbiologie ändert.
Zu viel RNA
Genetische Informationen werden aus den kodierenden Sequenzen des Genoms abgelesen, die durch Gene repräsentiert werden. Nur ein kleiner Teil des Genoms von Eukaryoten (Pflanzen, Tiere, Pilze) enthält Gene, und der Hauptteil besteht aus ausgedehnten Nukleotidsequenzen mit kaum verstandenen Funktionen. Im menschlichen Genom ist nur ein Viertel von Genen bedeckt und nur 1 % der DNA-Sequenzen kodieren Informationen, die in funktionellen RNA-Molekülen aufgezeichnet sind (Teil des Dogmas „DNA → RNA“). Das heißt, 1 % der genomischen DNA enthält Informationen über alle RNA-Moleküle. Warum brauchen wir die restlichen 99 %?
In den letzten Jahren wurde deutlich, dass intergene DNA-Regionen eine regulatorische Funktion haben: Sie enthalten Systeme und Elemente, die eine Feinabstimmung der Genoperation ermöglichen und sie in bestimmten Geweben des Körpers oder in bestimmten Entwicklungsstadien ein- oder ausschalten. An solche Elemente binden verschiedene Komplexe, die Moleküle regulatorischer Proteine und RNA enthalten. Bereits auf dieser Ebene ist es offensichtlich, dass das Modell „DNA → RNA → Protein“ nicht vollständig funktioniert, da der Großteil der DNA nicht zur Entstehung von RNA führt, sondern andere Funktionen trägt.
Einige Gene kodieren RNA mit regulatorischen Funktionen. Diese RNAs enthalten keine Informationen über die Proteinsequenz, sondern organisieren in erster Linie die Proteinsynthese in der Zelle. Der Hauptbestandteil solcher RNAs sind Bestandteile von Ribosomen (ribosomale RNAs), Komplexe, die die Translation durchführen, sowie Aminosäureträgermoleküle (Transfer-RNAs), die für die Teilnehmer am Prozess der Proteinsynthese auf einer RNA-Matrix (Translation) notwendig sind. 90 % aller RNA in einer Zelle gehört zu den aufgeführten Typen.
Unter den verbleibenden 10 % der RNA-Moleküle sind alle proteinkodierenden RNAs vertreten, aber auch unter diesen RNAs finden sich nicht-kodierende Moleküle, insbesondere kleine Kern-RNAs. Diese RNAs sind wesentliche Bestandteile des Spleißkomplexes. Beim Spleißen werden nicht-kodierende Regionen (Introns) aus dem primären RNA-Molekül entfernt und kodierende Regionen (Exons) nacheinander verbunden. Die resultierende Boten-RNA (mRNA) enthält sofort lesbare Proteinsequenzinformationen.
Es ist dieser Komplex, der die mRNA-Vorläufer für die Synthese der richtigen Proteine vorbereitet – indem er aus der Mitte der RNA Sequenzen herausschneidet, die keine Informationen über die Zusammensetzung des Proteins tragen, aber regulatorische Elemente enthalten. Der „RNA → Protein“-Teil des Dogmas hat also seine Grenzen.
Molekulare „Qualitätskontrolle“
Was wissen wir über die sogenannten „proteinkodierenden“ Gene? In prokaryontischen Zellen (Bakterien) ist für diesen Gentyp alles einfach: RNA-Moleküle werden auf einer DNA-Matrix transkribiert und auf ihrer Basis Proteinmoleküle synthetisiert. Am häufigsten sind RNA-Moleküle während der Transkription zur Synthese bereit.
In eukaryotischen Zellen ist alles viel komplizierter: RNA-Moleküle, die bei der Transkription synthetisiert werden, sind noch nicht bereit für die Translation (Proteinsynthese), sondern müssen zunächst eine Reihe von Veränderungen durchlaufen. An den Enden von RNA-Molekülen werden bestimmte Modifikationen vorgenommen (und die RNA wird stabil und gelangt auch in bestimmte Bereiche der Zelle – „Proteinfabriken“), Introns werden aus der Mitte der Moleküle herausgeschnitten. Ohne das Spleißen und Kombinieren von Exons kann das richtige Proteinmolekül nicht synthetisiert werden.
Mit zunehmender Komplexität der Genome nimmt der Beitrag des Spleißens zum Prozess der mRNA-Reifung zu: Bei Hefe werden nur 4 % der proteinkodierenden Gene gespleißt, bei Drosophila 83 % und beim Menschen 94 %. Die meisten menschlichen Gene enthalten mehr als ein Intron in ihrer Zusammensetzung und mehr als die Hälfte der menschlichen Gene können auf verschiedene Arten gespleißt werden. Spleißen ist also ein zusätzlicher Regulierungsmechanismus, der die Menge der „richtigen“ RNA steuert, auf deren Matrix die Synthese von Proteinmolekülen gestartet werden kann.
Darüber hinaus ist das Spleißen häufig eine Art „Qualitätskontrolle“ von RNA-Molekülen und reguliert deren Stabilität. Und da alternatives Spleißen zur Bildung verschiedener Varianten reifer mRNA auf der Grundlage desselben RNA-Moleküls führt, ist dies eine Möglichkeit, für zusätzliche Proteinvielfalt in der Zelle zu sorgen. Eine solche Vielfalt ist für eine bessere Anpassungsfähigkeit des Organismus notwendig: Verschiedene Proteinisoformen können in verschiedenen Zelltypen wirken, in verschiedene Kompartimente transportiert werden oder unterschiedliche Erkennungsoberflächen für Liganden bilden usw.
Worüber machen Gene Lärm?
Nicht alle Proteinisoformen haben bekannte Funktionen und in vielen Fällen kann das Proteinprodukt für alternativ gespleißte RNA-Moleküle nicht nachgewiesen werden. Die Autoren dieses Artikels in Wissenschaftliche Berichte, der alternativ gespleißte Produkte in einem Moosmodell untersuchte, konnte für die meisten der alternativ gespleißten mRNA-Moleküle keine Proteine finden. Auch in Studien an anderen Modellorganismen wurden für viele alternativ gespleißte mRNA-Varianten keine Proteinmoleküle gefunden.
Möglicherweise sind solche Moleküle ein Nebenprodukt der Regulierung des „Ausmaßes“ der Genexpression, des „Genrauschens“; oder einige Proteinisoformen werden in äußerst begrenzten Mengen benötigt.
Darüber hinaus enthalten viele Introns von Genen regulatorische Elemente, die Spleißprozesse steuern, und möglicherweise sind auch nichtkodierende RNAs am Zellstoffwechsel beteiligt. So können die Vielfalt der Isoformen und sogar die Proteinexpression direkt durch RNA-Moleküle gesteuert werden, ohne dass DNA beteiligt ist.
Mit der Entwicklung genomweiter Technologien erscheinen immer mehr Arbeiten zu nichtkodierenden RNA-Molekülen. Das menschliche Genom enthält einen riesigen Pool solcher RNAs – „lang“ und „kurz“: Sie erfüllen wichtige regulatorische Funktionen in der Zelle. Diese RNAs überwachen die Stabilität proteinkodierender RNAs, aktivieren oder unterdrücken Gene und fungieren als Sensoren bei verschiedenen Belastungen. Die Funktionen des Hauptteils der nichtkodierenden RNA sind noch nicht beschrieben; es handelt sich um eine ganze Welt, ohne die eine Zelle und ein Organismus nicht existieren können.
Die bisher gesammelten Daten legen nahe, dass Leben auf molekularer Ebene eine Form der Umsetzung von RNA-Funktionen ist. DNA speichert Informationen, Protein ist für den Zellstoffwechsel verantwortlich und das Leben einer Zelle (und eines Organismus) wird auf der Funktionsstufe der RNA-Moleküle organisiert und gesteuert.
Es gibt sogar Hinweise darauf, dass RNA zu Beginn der Evolution das erste Biopolymer war, das zur Selbstreproduktion fähig war. Einerseits kann RNA wie DNA ein Speicher für genetische Informationen sein (die Genome einer großen Gruppe von Viren werden durch RNA repräsentiert). Andererseits sind auch RNAs mit katalytischer Funktion bekannt, die einige Funktionen von Proteinen übernehmen können. Befürworter der RNA-Welt glauben, dass die Eigenschaften der RNA, die es ihnen ermöglichten, in Nukleotidsequenzen aufgezeichnete Informationen durch ihre eigene enzymatische Aktivität zu reproduzieren, eine entscheidende Rolle bei der Bildung des genetischen Apparats lebender Organismen spielten.
Die Zeit für solche Verallgemeinerungen ist noch nicht gekommen. Wissenschaftler beginnen gerade erst zu verstehen, dass das System, das sie seit 100 Jahren untersuchen, viel komplexer ist, als es noch vor 20 Jahren schien.
In den letzten Jahren hat diese Theorie über den Ursprung des Lebens immer mehr Anhänger gefunden und ist bei der Lösung dieses Problems dominant geworden. Sein Wesen liegt darin, dass die Begründer des Lebens keine Proteine, sondern RNA-Moleküle waren. Die Bildung der Bestandteile von RNA-Monomereinheiten – Ribose-Kohlenhydrat-Zyklen und heterozyklische Basen – bereitete, wie bereits gezeigt, keine grundsätzlichen Schwierigkeiten. Es ist viel schwieriger, sich den Prozess der Bildung von Nukleosiden direkt aus ihnen und dann deren Kombination zu NCs vorzustellen. Tatsächlich könnte sich eine solche Synthese unter den Bedingungen eines Homophasenprozesses in einem gasförmigen oder flüssigen Medium als äußerst schwierig erweisen. Allerdings ist die Durchführung unter Bedingungen der Heterophasenkatalyse auf einem festen Träger relativ einfach. Letztere sind viele Mineralien der Erdkruste: Calciumcarbonat, Kaolinit, Montmorillonit, Aluminiumverbindungen, Zeolithe. Gleichzeitig tragen sie nicht nur zur Beschleunigung der Synthese, sondern auch zur richtigen Ausrichtung der reagierenden Komponenten bei. Auf solchen Substraten wurde zunächst die Vernetzung von Nukleosiden und dann die Bildung einer Internukleotidbindung unter Beteiligung von Phosphorsäure oder ihren Derivaten durchgeführt. So war es beispielsweise möglich, Oligocytidin, also ein kurzes RNA-Molekül, das nur aus einem Nukleosidtyp besteht, auf einem Montmorillonit-Substrat aus 5"-Phosphorimidazolid-Cytidin zu synthetisieren. Auf ähnliche Weise wurden komplexere Oligonukleotide erhalten, die Nukleoside verschiedener Typen enthielten. Das ist so Interessant ist, dass die RNA-Kette sehr lange stabil blieb. Gleichzeitig konnten lange Oligonukleotide, die sich auf einer mineralischen Matrix befanden, an Di- und Trinukleotide binden, indem sie Wasserstoffbrückenbindungen zwischen komplementären Basen bildeten. Zwischen diesen Di konnten sich auch Internukleotidbindungen bilden - und Trinukleotide. Auf diese Weise wurde die Synthese von Tochter-RNA auf der RNA-Matrix durchgeführt, d Trinukleotide kontaktierten AK-Moleküle beispielsweise aufgrund hydrophober Wechselwirkungen oder Wasserstoffbrückenbindungen und übertrugen sie auf die RNA-Matrize. Di- und Trinukleotide interagierten mit dem RNA-Molekül über Wasserstoffbrückenbindungen. Dadurch werden AKs tragende Nukleotide in der Nähe der RNA-Kette aufgereiht. Wenn sie nahe beieinander lagen, wurde es möglich, Peptidbindungen zwischen AK-Molekülen unter Bildung eines Polypeptids – eines kleinen „Proteins“ – zu bilden. Auf diese Weise wurde die Translationsreaktion realisiert, und zwar ohne die Beteiligung von Enzymproteinen. Es ist hier besonders wichtig zu betonen, dass alle diese Prozesse auf sehr spezifische Weise durchgeführt wurden, da die Bildung von Wasserstoffbrückenbindungen zwischen verschiedenen Molekülen sehr selektiv ist: Die Wechselwirkungen, bei denen die meisten Wasserstoffbrückenbindungen realisiert werden, sind am stabilsten . Unter Bedingungen des Gleichgewichts der Prozesse führte diese Selektivität zur Reproduktion bestimmter Moleküle: Jede Matrix „produzierte“ Produkte, die für sie einzigartig waren. Eine solche Synthese könnte in primären Koazervattröpfchen stattfinden. Dies führte zur Anhäufung einer klar definierten Gruppe von Biomolekülen in jedem von ihnen, aber die Vielfalt der Tröpfchen selbst und die Bedingungen, unter denen sie existierten, boten große Möglichkeiten für die Auswahl der stabilsten Tröpfchen, was bereits eine Protoevolution war. Die Tropfen, die sich durch Teilung selbst reproduzierten, wuchsen an Größe und wurden immer komplexer und enthielten immer mehr Substanzen. So könnte die erste Zelle entstanden sein.
Es ist jedoch unklar, ob RNA das erste lebensbildende Molekül war oder ob es ältere Vorgänger gab. Vor einiger Zeit wurde eine chimäre Substanz namens Peptidnukleinsäure (PNA) synthetisiert, bei der das Rückgrat der Kette aus Molekülen der Aminosäure N-(2-Aminoethyl)glycin bestand und an dieses Rückgrat heterozyklische Basen gebunden waren . Daher wurde das Zucker-Phosphat-Rückgrat durch ein Polypeptid-Rückgrat ersetzt. Derzeit betrachten einige Forscher PNA als einen Kandidaten für die Rolle eines möglichen RNA-Vorläufers, obwohl die präbiotische Rolle von PNA noch nicht eindeutig bewiesen ist.
Artikel zum Wettbewerb „bio/mol/text“: Die Idee, dass Leben aus sich selbst replizierenden RNA-Molekülen entstanden sein könnte, ist nicht mehr neu. Tatsächlich vereint RNA sowohl die Funktion der Speicherung von Erbinformationen als auch die Fähigkeit zur biochemischen Katalyse. Mittlerweile hat sich die RNA-Welthypothese von einer rein spekulativen Theorie zu einem theoretischen Modell entwickelt, das über eine gute beweiskräftige und experimentelle Grundlage verfügt. Natürlich wirft diese Theorie viele Fragen auf, kann aber dennoch zu Recht als eine der fundiertesten Hypothesen zur Entstehung des Lebens auf der Erde bezeichnet werden.
Kontroversen der RNA-Welthypothese
Die Idee der RNA-Welt wurde 1968 von Carl Woese vorgeschlagen und schließlich 1986 vom Nobelpreisträger Walter Hilbert formuliert. Dass RNA in der Lage ist, sowohl Erbinformationen zu speichern als auch Arbeiten zu verrichten (z. B. bei der Proteinbiosynthese), war bereits früher bekannt. Die Hypothese der RNA-Welt konnte jedoch erst nach der Entdeckung der ribosomalen RNA aus dem bewimperten Protozoen im Jahr 1981 endgültig aufgestellt werden Tetrahymena, das zum Autospleißen fähig ist. Dies geschieht wie folgt: Ein Nukleotid G wird an die Intronsequenz der RNA angehängt, dann wird die Kette an der Anheftungsstelle des Nukleotids durchtrennt. Danach erfolgt die endgültige Entfernung des Introns und das Zusammenfügen der Exons. Darüber hinaus weist diese intronische Sequenz Ribonukleaseaktivität auf, d. h. Es ist in der Lage, an Substrat-RNA zu binden und diese gezielt zu schneiden. Solche Eigenschaften werden dem ribonukleären Intron durch seine Fähigkeit verliehen, komplexe dreidimensionale Strukturen zu bilden.
Der Preis für die hohe Labilität der RNA ist jedoch ihre Tendenz zum schnellen Abbau. Hier stoßen wir auf die erste Schwierigkeit des RNA-Weltkonzepts. Wie kann ein Molekül als zuverlässiger Speicher für genetische Informationen dienen, wenn seine Lebensdauer kurz ist?
Bei Säugetieren beträgt die Lebensdauer von mRNA in Zellen mehrere Minuten bis mehrere Stunden oder höchstens Tage. In Bakterien „lebt“ die mRNA von wenigen Sekunden bis etwas mehr als einer Stunde. Stimmen Sie zu, eine zuverlässige Speicherung von Informationen hält nicht lange an! Darüber hinaus trug die aggressive Umgebung unter präbiotischen Bedingungen kaum zur Stabilität der Moleküle bei.
Dieser Widerspruch kann durch einige Annahmen gelöst werden. Man geht davon aus, dass sich die ersten RNAs in Mikrokavitäten im Eis vermehren konnten. Dies wird durch eine Reihe von Experimenten gestützt, bei denen die maximale Ribozymaktivität von RNA bei einer Temperatur von etwa −8 °C beobachtet wird. Dies kann daran liegen, dass bei solchen Temperaturen die RNA-Konzentration zunimmt und die Wasseraktivität abnimmt. Die wahrscheinliche Schwierigkeit besteht hier jedoch darin, dass RNA bei niedrigen Temperaturen eine erhöhte Tendenz zur Bildung von Wasserstoffbrückenbindungen zwischen komplementären Nukleotiden entwickelt, was zur Bildung intermolekularer Komplexe und einer Abnahme der katalytischen Aktivität führt.
Die nächste große Schwierigkeit ist die Tendenz der RNA, bei pH>6 zu hydrolysieren. Phosphodiesterbindungen zwischen Nukleotiden sind bei pH-Werten zwischen 4 und 5 am stabilsten.
Mg 2+ -Ionen spielen zudem eine doppelte Rolle: Einerseits stabilisieren sie die Sekundär- und Tertiärstrukturen der RNA (die für die Katalysefähigkeit entscheidend sind), andererseits fördern sie durch ihre hohe Konzentration den Abbau von Molekülen. Oben wurde erwähnt, dass RNA-Moleküle in einer sauren Umgebung am stabilsten sind. Unter diesen Bedingungen werden Cytosin und Adenosin protoniert und erhalten dadurch eine zusätzliche positive Ladung, was den Bedarf an Kationen verringert. Beispielsweise behalten einige Ribozyme bei pH = 4 ihre Aktivität auch in Abwesenheit von Ionen.
RNA ist ein sehr komplexes Molekül und die Wahrscheinlichkeit, dass es plötzlich aus einzelnen Atomen oder Fragmenten entsteht, ist äußerst gering. Tatsächlich ist es schwer vorstellbar, wie eine stickstoffhaltige Base, Ribose und Phosphat zusammenkommen könnten, um ein Nukleotid zu bilden. Sanchez, Orgel, Powner und Sutherdand zeigten jedoch die Möglichkeit, Pyrimidine aus Molekülen zu synthetisieren, die wahrscheinlich unter präbiotischen Bedingungen auf der Erde vorkommen.
Es ist auch wichtig zu verstehen, wie die Polymerisation der ersten Nukleotide zu Polymerketten ablief. Vor relativ kurzer Zeit wurde die wichtige Rolle verschiedener Mineralien und Metallionen bei der Katalyse bei der Bildung von Biopolymeren entdeckt. Montmorillonit katalysiert beispielsweise die Polymerisation von Nukleotiden, deren 5′-Phosphat zuvor durch Imidazol aktiviert wurde. Darüber hinaus ist Montmorillonit in der Lage, aus einfachen Fettsäuren Vesikel zu bilden. Somit fördert dieses Mineral einerseits die Polymerisation von Nukleotiden und andererseits die Bildung von Membranstrukturen.
Hypothetisch gibt es viele Möglichkeiten, Ribonukleotide über verschiedene Riboseatome miteinander zu verbinden. In lebenden Organismen sind Nukleotide jedoch über eine 3′,5′-Phosphodiesterbindung miteinander verbunden (mit einigen Ausnahmen: Beispielsweise ist die Kappe in eukaryontischer mRNA über eine 5′,5′-Bindung befestigt). Jüngste Studien von Shostak zeigten, dass Ribozyme, die Nukleotide enthalten, die sowohl über eine 3′,5′-Bindung als auch eine 2′,5′-Bindung verbunden sind, ihre katalytischen Eigenschaften teilweise beibehalten. Es ist wahrscheinlich, dass in den ersten Ribonukleinpolymeren verschiedene Varianten der Phosphodiesterbindung realisiert werden konnten, aber es war die 3′,5′-Bindung, die durch die Evolution ausgewählt wurde.
Oft besitzen nur lange RNA-Ketten katalytische Aktivität. Dies ist einer der Hauptkritikpunkte an der RNA-Welttheorie, da die zufällige Entstehung langer Sequenzen, die biochemische Arbeit leisten können, sehr unwahrscheinlich ist. Eine der besten heute entwickelten Ribozym-Replikasen kann bis zu 95 Nukleotide replizieren, ist selbst aber 190 Nukleotide lang (siehe Seitenleiste). Die Länge dieser Sequenz ist zu lang, um unter präbiotischen Bedingungen spontan zu entstehen. Forschung in vitro zeigen, dass zur Isolierung katalysefähiger Moleküle etwa 10 13 -10 14 RNA-Moleküle erforderlich sind – ziemlich viel, damit ein so langes Ribozym in fertiger Form erscheint. Die Entdeckung kurzer Ribozyme stellt jedoch die Vorstellung in Frage, dass astronomische Mengen an Molekülen für die Entstehung von RNA-Katalysatoren erforderlich sind. Tatsächlich wurden Polyribonukleotide mit aktiven Duplexen erhalten, die zur Selbstexzision fähig sind und eine Länge von nur 7 Resten haben. Darüber hinaus konnte nachgewiesen werden, dass selbst ein auf nur fünf Nukleotide gekürztes Ribozym seine enzymatischen Fähigkeiten beibehielt. Allerdings ist die katalytische Aktivität von Miniribozymen deutlich geringer als die ihrer längeren „Brüder“. Daraus folgt, dass kurze Ribozyme die evolutionären Vorläufer langer Ribozyme sein könnten. Mit der Zeit nahmen sie an Länge zu, was zu einer regelmäßigeren Struktur und damit zu verbesserten katalytischen Eigenschaften beitrug.
Ribozym-Replikasen
Damit sich Polyribonukleotide in der RNA-Welt vermehren konnten, musste es Ribozym-Analoga von Proteinpolymerasen geben. Ribozyme mit dieser Art von Aktivität wurden in modernen lebenden Organismen nicht gefunden, ähnliche Moleküle wurden jedoch künstlich hergestellt. Molekularbiologen aus Großbritannien machten auf das bereits bekannte Ribozym R18 aufmerksam, das über Polymeraseaktivität verfügt. Es wurde zum Gegenstand des Experiments: Durch künstliche Evolution und intelligente Planung wurden aus dem ursprünglichen Ribozym vier neue Moleküle mit verbesserten katalytischen Eigenschaften gewonnen. Tatsache ist, dass das ursprüngliche Ribozym R18 (im Bild durch den Buchstaben A gekennzeichnet) nur RNA-Fragmente mit einer Länge von bis zu 20 Nukleotiden replizieren konnte. Auch konnte damit nicht jede RNA-Sequenz repliziert werden, sondern nur ein enger Bereich bestimmter Matrizen. Wissenschaftler gingen zwei Wege:
Dadurch wurden die vorteilhaften Eigenschaften der tC19- und Z-Ribozyme in einem einzigen Ribozym namens tC19Z vereint. Dieses Ribozym ist in der Lage, sowohl eine ziemlich große Bandbreite an Templates als auch ziemlich lange Sequenzen zu kopieren.
In Tyrosin-tRNA in komplexen Organismen wie Menschen und blühenden Dikotyledonen wurden Introns gefunden, die zur Selbstexzision fähig sind. Arabidopsis thaliana. Diese 12- und 20-Nukleotid-Regionen in der Zelle werden durch Spleißen unter Beteiligung von Proteinen geschnitten, aber dieses Intron hat die Fähigkeit gezeigt, sich selbst ohne die Beteiligung von Enzymen zu schneiden.
RNA-Schalter
Die begrenzte katalytische Fähigkeit von Ribozymen wird oft zu einem weiteren schwachen Eckpfeiler der RNA-Welttheorie. Kritiker der Theorie glauben, dass die minimalen chemischen Reaktionen, die für den Stoffwechsel in der RNA-Welt notwendig sind, nicht durch Ribozyme allein bereitgestellt werden können. Die überwiegende Mehrheit der RNA-Katalysatoren katalysiert lediglich das Aufbrechen und die Bildung von Phosphodiesterbindungen zwischen Nukleotiden. Es scheint, dass RNA-Moleküle mit ihren vier sehr ähnlichen Monomeren in ihrer chemischen Vielfalt den Proteinen, die 20 Aminosäuren mit sehr unterschiedlichen Eigenschaften enthalten, hoffnungslos unterlegen sind. Wir sollten jedoch nicht vergessen, dass viele Proteinenzyme, um aktive Arbeit zu leisten, Liganden – Cofaktoren – anbinden müssen, ohne die die enzymatische Aktivität einfach verschwindet.
Und hier lohnt es sich, sich zu erinnern RNA-Schalter oder Riboschalter (Englisch Riboschalter). Was ist es? Bekanntlich werden Informationen über die Aminosäuresequenz eines Proteins durch mRNA an das Ribosom übermittelt. Messenger-RNA wird durch das Enzym DNA-Polymerase II aus DNA transkribiert. Dabei wird neben dem Gen selbst auch die Region davor transkribiert, auf der sich der Riboper-Schalter befindet. Ein RNA-Schalter ist ein Abschnitt der mRNA, der in der Lage ist, ein Molekül einer genau definierten Substanz zu binden. Sobald der Schalter gebunden ist, ändert er seine räumliche Konfiguration, wodurch eine weitere Transkription unmöglich wird.
Es ist wichtig, das Funktionsprinzip von RNA-Schaltern zu verstehen. Lassen Sie uns daher ein paar Worte zu ihrer Struktur sagen. Es besteht aus zwei Teilen: Aptamer und „Ausdrucksplattform“. Ein Aptamer ist im Wesentlichen ein Rezeptor, der mit sehr hoher Selektivität an ein bestimmtes Molekül bindet. Das Effektormolekül für ein Aptamer ist ein Molekül, das von dem Protein produziert wird, dessen Gen durch den Schalter reguliert wird. Die „Expressionsplattform“ ist der RNA-Schalter selbst, der nach der Bindung des Rezeptors an den Liganden seine Konfiguration ändert und die weitere Transkription verhindert.
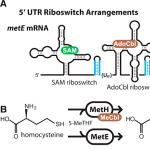
Es gibt jedoch auch RNA-Schalter, die über einen komplexeren Mechanismus funktionieren. Zum Beispiel ein Riboschalter, der die Gentranskription steuert metE Bakterien Bacillus clausii, ist doppelt, d.h. verfügt über zwei Rezeptorstellen, die zwei verschiedene Moleküle binden. Schauen wir uns diesen Mechanismus genauer an.
Gen metE kodiert für ein Enzym, das umwandelt Homocystein in die Aminosäure Methionin umgewandelt. Methionin wird dann (von einem anderen Enzym) zur Synthese von S-Adenosylmethionin (oder einfacher SAM) verwendet. Außer dem Gen metE, es gibt noch ein anderes Gen - metН. Genprotein metН katalysiert die gleiche Reaktion, jedoch mit größerer Effizienz als metE. Jedoch metН Für seine Arbeit benötigt es ein Coenzym – Methylcobalamin (oder MeCbl), das aus Adenosylcobalamin (oder AdoCbl) synthetisiert wird. Hier also das Transkript metE verfügt über einen RNA-Schalter, der zwei Bindungsstellen enthält: eine für SAM, die andere für AdoCbl. Dieser Schalter kann als NOR-Gatter (und/oder) fungieren. Das heißt, ausschalten metE Es reicht aus, eines der Effektormoleküle oder beide an die Riboswitch-Rezeptoren zu binden. Der Mechanismus der Translationsunterbrechung selbst basiert auf der Bildung einer Haarnadel durch Entfernung von sechs Nukleotiden aus dem Riboschalter (Abb. 1A). Die Logik der Aktionen eines solchen NOR-Elements lässt sich wie folgt beschreiben: „Ich unterdrücke die Transkription, wenn entweder Substanz A oder Substanz B oder beide Substanzen in der Umwelt vorhanden sind.“. Man kann nur staunen, wie schön und elegant die Lösungen der Natur sind!

Abbildung 1. Funktionsweise von Riboschaltern. A- Riboschalter auf metE-, metH- und metK-Gentranskripten. Haarnadelstrukturen, die durch Herausschneiden von sechs oder mehr Uridinnukleotiden entstehen, sind blau dargestellt. Es ist ersichtlich, dass metE zwei Akzeptor- und zwei Haarnadelstellen aufweist. IN- S-Adenosylmethionin-Biosyntheseweg. Im ersten Schritt wird Homocystein in die Aminosäure Methionin umgewandelt. Diese Umwandlung kann durch eines von zwei Enzymen katalysiert werden: MetE oder MetH. MetH führt diese Reaktion mit größerer Effizienz durch, benötigt für den Betrieb jedoch eine zusätzliche Substanz (Cofaktor). Im zweiten Schritt wandelt das Enzym MetK Methionin in S-Adenosylmethionin um.
Mittlerweile sind RNA-Schalter in der Lage, eine beträchtliche Anzahl von Protein-Cofaktoren wie Flavinmononukleotid, Thiaminpyrophosphat, Tetrahydrofolat, S-Adenosylmethionin und Adenosylcobalamin zu binden. Ursprünglich glaubte man, dass RNA-Schalter nur in der Lage seien, die Genexpression zu unterdrücken, doch später wurden Hinweise darauf gefunden, dass einige Schalter diese im Gegenteil verstärken. RNA-Schalter selbst sind ein sehr interessantes Phänomen, da sie die Möglichkeit demonstrieren, die Funktion von Genen ohne die direkte Beteiligung von Proteinen zu regulieren – mit anderen Worten, sie demonstrieren die Selbstversorgung und Vielseitigkeit von RNA. Offenbar handelt es sich bei RNA-Schaltern um einen sehr alten Mechanismus: Sie kommen beispielsweise in allen Bereichen der Lebewesen vor: Bakterien, Archaeen und Eukaryoten. Es scheint, dass zumindest einige der heutigen Protein-Cofaktoren direkt aus der RNA-Welt entlehnt wurden. Ein Bild lässt sich etwa so zeichnen: Ribozyme nutzten ursprünglich viele der modernen Cofaktoren für ihre Zwecke, aber mit dem Aufkommen effizienterer Proteinenzyme wurden diese Cofaktoren als letzte übernommen.

Abbildung 2. Sekundärstruktur des RNA-Switch-Gens metE. Akzeptoren werden identifiziert – Bindungsstellen mit SAM- und AdoCbl-Molekülen sowie Haarnadel-Terminierungsstrukturen.
Genomische Tags und tRNA

Abbildung 3. Sekundärstruktur der tRNA. Die Abbildung zeigt deutlich die für tRNA charakteristische Sekundärstruktur in Form eines „Kleeblattes“ A". In der oberen Hälfte Am 3′-Ende des Moleküls befindet sich eine CCA-Region und eine Akzeptorschleife, die die Aminosäure bindet. Im unteren Teil Das Molekül enthält eine Anticodon-Schleife, die für die komplementäre Bindung an das mRNA-Codon verantwortlich ist. Gemäß der Genom-Tag-Hypothese entwickelten sich die obere und untere Hälfte der tRNAs getrennt, wobei die obere Hälfte älter als die untere Hälfte war.
Jeder ist sich der wichtigen Rolle der tRNA bei der Proteinbiosynthese bewusst. tRNA und ähnliche Moleküle haben jedoch noch eine weitere, weniger bekannte, aber nicht weniger wichtige Funktion: Sie fungieren als Primer und Template in verschiedenen Replikationsvorgängen. Dies können die Prozesse der einzelsträngigen viralen RNA-Replikation, der mitochondrialen DNA-Replikation in Pilzen und der Telomerreplikation sein.
Wenden wir uns der viralen RNA zu. Das 3′-Ende vieler Bakterien- und Pflanzenviren ist strukturell der „oberen Hälfte“ der modernen tRNA (dem Teil des Moleküls, der an eine Aminosäure bindet; Abb. 3) sehr ähnlich. Solche Regionen an den 3′-Enden werden „Genom-Tags“ genannt. Der Tag fungiert als Vorlage für die Initiierung der viralen RNA-Replikation. Darüber hinaus sind diese Regionen „echten“ tRNAs so ähnlich, dass sie mithilfe eines Enzyms aminoacyliert werden können (d. h. eine Aminosäure an sie angehängt werden kann). Aminoacyl-tRNA-Synthetasen .
Außerdem beginnt die Replikation vieler RNAs in Retroviren damit, dass sich die Wirts-tRNA mit der Primerbindungsstelle auf der viralen RNA verbindet. Dies zeigt, dass die tRNAs moderner Organismen auch als Primer dienen können. Dann verwenden wir tRNA als Primer, umgekehrte Transkriptase kopiert das virale RNA-Genom in DNA.
Ist es möglich, dass sich die tRNAs heutiger Organismen aus alten genomischen Tags entwickelt haben? Alan Weiner und Nancy Meitzels beantworten diese Frage mit Ja. Ihrer Theorie zufolge entwickelten sich die obere und untere Hälfte der tRNA getrennt, wobei der obere Teil der tRNA vor dem unteren erschien und ein Nachkomme genomischer Tags war.
Ursprung der Ribosomen
Bei der Konstruktion der Hypothese der RNA-Welt wird viel Wert auf den Ursprung der Ribosomen gelegt, da ihre Entstehung tatsächlich mit dem Übergang von der RNA-Katalyse zu einem Proteinprozess gleichgesetzt werden kann. Wie Sie wissen, besteht das Ribosom aus zwei Untereinheiten: einer kleinen und einer großen. Die große ribosomale Untereinheit spielt eine Schlüsselrolle bei der Synthese der Proteinkette, während die kleine die mRNA liest. Ein Modell für den Ursprung eines der Moleküle der großen Untereinheit wurde von den kanadischen Biochemikern Konstantin Bokov und Sergei Steinberg vorgeschlagen.
Sie konzentrierten sich auf die 23s-rRNA (bestehend aus sechs Domänen, I–VI), da sich in diesem Molekül das Funktionszentrum befindet, das für die Transpeptidierungsreaktion (Anbindung einer neuen Aminosäure an eine wachsende Polypeptidkette) verantwortlich ist. Dieses Molekül enthält etwa dreitausend Nukleotide und ist in der Lage, komplexe dreidimensionale Strukturen zu bilden. Sogenannte A-Minor-Bindungen spielen eine wichtige Rolle bei der Aufrechterhaltung der dreidimensionalen Struktur des Moleküls. Dabei handelt es sich um Bindungen zwischen „Stapel“ von Nukleotiden (normalerweise Adenosinen) mit Regionen, die Doppelhelices bilden. Bindungen werden zwischen Helices und Stapeln gebildet, die sich in verschiedenen Regionen des Moleküls befinden.
Die 23s-rRNA ist zu komplex, als dass sie sofort in fertiger Form erscheinen könnte. Dementsprechend muss das Molekül eine einfachere Struktur enthalten, von der aus seine Entwicklung begann. Domäne V hat bei Forschern besondere Aufmerksamkeit auf sich gezogen. Das Interessante daran war, dass es eine große Anzahl von Doppelhelices und praktisch keine Adenosinstapel enthält. Das schreiben die Autoren der Studie dazu: „Um die in Domäne V auftretende Anomalie zu erklären, stellten wir die Hypothese auf, dass sie die Reihenfolge widerspiegelt, in der verschiedene Teile der 23s-rRNA im Laufe ihrer Entwicklung hinzugefügt wurden. In A-Moll-Motiven hängt die Konformationsstabilität von Adenosinstapeln von der Anwesenheit von Doppelhelices ab, während Doppelhelices selbst in der Lage sind, eine stabile Struktur aufrechtzuerhalten.“. Daraus folgt, dass Domäne V der älteste Teil des Moleküls ist: Seine helikalen Bereiche, die dem gesamten Molekül Stabilität verleihen, sollten vor anderen Teilen mit Adenosinstapeln aufgetreten sein. Darüber hinaus befindet sich in der fünften Domäne das Funktionszentrum, das für die Bildung einer Peptidbindung während der Proteinbiosynthese verantwortlich ist.
Es stellt sich heraus, dass die fünfte Domäne sowohl das funktionelle Zentrum des Moleküls als auch sein Strukturgerüst ist. Dies deutet darauf hin, dass damit die Evolution der 23s-rRNA begann. Als nächstes versuchten die Autoren, die Evolution der 23s-rRNA zu rekonstruieren. Dazu zerlegten sie das Molekül in 60 relativ kleine Abschnitte und versuchten, es so zu „zerlegen“, dass sie durch die schrittweise Entfernung von Teilen die Struktur des verbleibenden Moleküls nicht beschädigten. Wenn wir die Details weglassen, weisen wir darauf hin, dass die Schlussfolgerung genau diese war: Die Entwicklung dieses Moleküls begann genau am Peptidyltransferase-Zentrum der fünften Domäne, da es beim Zerlegen die letzte intakte Region blieb (siehe Abb. 4). Forscher glauben, dass es sich bei dieser Struktur um das uralte „Protoribosom“ handelt. Kann dieser kleine Teil eines riesigen Moleküls seine Aufgabe alleine erledigen? Die Forschung gibt eine positive Antwort. Bei den Experimenten wurden künstlich gezüchtete Ribozyme gewonnen, die in der Lage waren, die Transpeptidierungsreaktion durchzuführen.

Abbildung 4. Entwicklung des „Protoribosoms“. Links- Sekundärstruktur der 23s-rRNA. Rote Kreise stellen helikale Regionen dar, gelbe Kreise stellen Adenosin-„Stapel“ dar. Blaue Linien zeigen A-Moll-Verbindungen. Römische Ziffern repräsentieren die Domänen des Moleküls. Es ist deutlich zu erkennen, dass sich die größte Anzahl helikaler Regionen in Domäne V befindet. Rechts- Um den Evolutionsprozess der 23s-rRNA herauszufinden, teilten die Autoren das Molekül in 60 Strukturblöcke auf. Als nächstes versuchten sie, das Molekül zu „zerlegen“, damit das Molekül nach sukzessiver Entfernung dieser Blöcke weiterarbeiten konnte. Zunächst trennten sie 19 Blöcke, ohne die übrigen zu beschädigen. Danach war es möglich, 11 weitere Blöcke zu trennen, und dann nacheinander 9, 5, 3, 3, 2, 2, 2. Dann stellte sich heraus, dass es möglich war, drei weitere Blöcke nacheinander zu trennen.
Offenbar war es die fünfte Domäne, die als „Ausgangspunkt“ in der Evolution der 23s-rRNA diente. Später wurden ihm verschiedene Blöcke hinzugefügt, um die Leistung des Moleküls zu verbessern. An das Protoribosom wurden zunächst acht Blöcke angehängt, die eine „Basis“ bildeten, was zu einer Erhöhung der Stabilität des gesamten Moleküls führte. Dann wurden die nächsten 12 Blöcke hinzugefügt, die Strukturen bildeten, die es den großen und kleinen Untereinheiten ermöglichten, sich miteinander zu verbinden. Die letzten Blöcke, die hinzugefügt wurden, waren diejenigen, die die sogenannten bildeten. „Protuberanzen“ sind Vorsprünge auf der Oberfläche der großen Untereinheit. Die Funktion dieser Auswüchse besteht darin, dem Ribosom bei der Auswahl der gewünschten Aminoacyl-tRNA zu helfen und die tRNA, die ihre Aminosäure bereits an das wachsende Proteinmolekül gespendet hat, „in die Wildnis freizusetzen“.
Spuren der RNA-Welt
Das Erbe der RNA-Welt kann in jedem lebenden Organismus gefunden werden. Erinnern wir uns an Ribosomen, die offenbar Relikte einer sehr langen Ära sind, denn strukturell und funktionell sind Ribosomen bei Menschen, Regenwürmern und E. coli äußerst ähnlich. Der Hauptenergieträger der Zelle, das Adenosintriphosphat-Molekül, ist nichts anderes als Adenosin mit zwei zusätzlichen Phosphaten. Auch so wichtige Moleküle wie die Elektronenträger FAD und NAD sind modifizierte Nukleotide. Natürlich ist die RNA-Welt-Hypothese noch nicht bewiesen und es gibt keine Garantie dafür, dass sie jemals eintreten wird. Aber die Tatsache, dass die wichtigsten Prozesse in einer Zelle unter aktiver Beteiligung von RNA und Ribonukleotiden ablaufen, kann als starkes Argument für die Wahrheit dieser Theorie dienen.
Literatur
- Carl Woese (1928–2012);
- Harold S. Bernhardt. (2012). Die RNA-Welthypothese: die schlechteste Theorie der frühen Evolution des Lebens (außer allen anderen)a . Biologie direkt. 7 , 23;
- C. Briones, M. Stich, S. C. Manrubia. (2009). Der Beginn der RNA-Welt: Auf dem Weg zu funktioneller Komplexität durch Ligation zufälliger RNA-Oligomere. R.N.A.. 15 , 743-749;
- Matthew W. Powner, Béatrice Gerland, John D. Sutherland. (2009). Synthese aktivierter Pyrimidin-Ribonukleotide unter präbiotisch plausiblen Bedingungen. . Biol. Stier. 196 , 327–328;
- Konstantin Bokov, Sergey V. Steinberg. (2009). Ein hierarchisches Modell für die Evolution der ribosomalen 23S-RNA. Natur. 457 , 977-980;
- Elemente: «