Die Anordnung von Elektronen auf Energieschalen oder -niveaus wird mithilfe elektronischer Formeln chemischer Elemente beschrieben. Elektronische Formeln oder Konfigurationen helfen dabei, die atomare Struktur eines Elements darzustellen.
Atomare Struktur
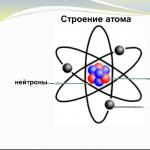
Die Atome aller Elemente bestehen aus einem positiv geladenen Kern und negativ geladenen Elektronen, die sich um den Kern herum befinden.
Elektronen haben unterschiedliche Energieniveaus. Je weiter ein Elektron vom Kern entfernt ist, desto mehr Energie hat es. Die Größe des Energieniveaus wird durch die Größe des Atomorbitals oder der Orbitalwolke bestimmt. Dies ist der Raum, in dem sich das Elektron bewegt.

Reis. 1. Allgemeine Struktur des Atoms.
Orbitale können unterschiedliche geometrische Konfigurationen haben:
- s-Orbitale- sphärisch;
- p-, d- und f-Orbitale- hantelförmig, in verschiedenen Ebenen liegend.
Das erste Energieniveau eines jeden Atoms enthält immer ein s-Orbital mit zwei Elektronen (Ausnahme: Wasserstoff). Ab der zweiten Ebene liegen die s- und p-Orbitale auf derselben Ebene.

Reis. 2. s-, p-, d- und f-Orbitale.
Orbitale existieren unabhängig von der Anwesenheit von Elektronen in ihnen und können besetzt oder leer sein.
Eine Formel schreiben
Elektronische Konfigurationen von Atomen chemischer Elemente werden nach den folgenden Prinzipien geschrieben:
- Jede Energiestufe hat eine entsprechende Seriennummer, die durch eine arabische Ziffer angezeigt wird.
- Auf die Zahl folgt ein Buchstabe, der das Orbital angibt.
- Über dem Buchstaben steht ein hochgestellter Index, der der Anzahl der Elektronen im Orbital entspricht.
Aufnahmebeispiele:

Ein Atom ist das kleinste Materieteilchen, bestehend aus einem Kern und Elektronen. Die Struktur der elektronischen Hüllen von Atomen wird durch die Position des Elements im Periodensystem der chemischen Elemente von D.I. bestimmt.
Elektron und Elektronenhülle eines Atoms
Ein im Allgemeinen neutrales Atom besteht aus einem positiv geladenen Kern und einer negativ geladenen Elektronenhülle (Elektronenwolke), wobei die gesamten positiven und negativen Ladungen im absoluten Wert gleich sind. Bei der Berechnung der relativen Atommasse wird die Masse der Elektronen nicht berücksichtigt, da sie vernachlässigbar ist und 1840-mal kleiner als die Masse eines Protons oder Neutrons ist.

Reis. 1. Atom.
Ein Elektron ist ein völlig einzigartiges Teilchen mit doppelter Natur: Es hat sowohl die Eigenschaften einer Welle als auch eines Teilchens. Sie bewegen sich ständig um den Kern.
Der Raum um den Kern herum, in dem die Wahrscheinlichkeit, ein Elektron zu finden, am größten ist, wird Elektronenorbital oder Elektronenwolke genannt. Dieser Raum hat eine bestimmte Form, die mit den Buchstaben s-, p-, d- und f- bezeichnet wird. Das S-Elektronenorbital hat eine Kugelform, das p-Orbital hat die Form einer Hantel oder einer dreidimensionalen Acht, die Formen der d- und f-Orbitale sind deutlich komplexer.

Reis. 2. Formen von Elektronenorbitalen.
Um den Kern herum sind Elektronen in Elektronenschichten angeordnet. Jede Schicht wird durch ihren Abstand zum Kern und ihre Energie charakterisiert, weshalb elektronische Schichten oft als elektronische Energieniveaus bezeichnet werden. Je näher die Ebene am Kern liegt, desto geringer ist die Energie der Elektronen darin. Ein Element unterscheidet sich von einem anderen durch die Anzahl der Protonen im Atomkern und dementsprechend durch die Anzahl der Elektronen. Folglich ist die Anzahl der Elektronen in der Elektronenhülle eines neutralen Atoms gleich der Anzahl der im Kern dieses Atoms enthaltenen Protonen. Jedes nachfolgende Element hat ein Proton mehr in seinem Kern und ein Elektron mehr in seiner Elektronenhülle.
Das neu eintretende Elektron besetzt das Orbital mit der niedrigsten Energie. Die maximale Anzahl an Elektronen pro Ebene wird jedoch durch die Formel bestimmt:
Dabei ist N die maximale Elektronenzahl und n die Zahl des Energieniveaus.
Die erste Ebene kann nur 2 Elektronen haben, die zweite kann 8 Elektronen haben, die dritte kann 18 Elektronen haben und die vierte Ebene kann 32 Elektronen haben. Die äußere Ebene eines Atoms kann nicht mehr als 8 Elektronen enthalten: Sobald die Anzahl der Elektronen 8 erreicht, beginnt sich die nächste Ebene, weiter vom Kern entfernt, zu füllen.
Struktur elektronischer Atomhüllen
Jedes Element steht in einem bestimmten Zeitraum. Eine Periode ist eine horizontale Ansammlung von Elementen, die in der Reihenfolge zunehmender Ladung der Kerne ihrer Atome angeordnet sind. Sie beginnt mit einem Alkalimetall und endet mit einem Inertgas. Die ersten drei Perioden in der Tabelle sind klein und die nächsten, beginnend mit der vierten Periode, sind groß und bestehen aus zwei Zeilen. Die Nummer der Periode, in der sich das Element befindet, hat eine physikalische Bedeutung. Es bedeutet, wie viele elektronische Energieniveaus es in einem Atom eines beliebigen Elements einer bestimmten Periode gibt. Somit befindet sich das Element Chlor Cl in der 3. Periode, das heißt, seine Elektronenhülle weist drei elektronische Schichten auf. Chlor gehört zur Gruppe VII der Tabelle und zur Hauptuntergruppe. Die Hauptuntergruppe ist die Spalte innerhalb jeder Gruppe, die mit Periode 1 oder 2 beginnt.
Somit ist der Zustand der Elektronenhüllen des Chloratoms wie folgt: Die Ordnungszahl des Chlorelements beträgt 17, was bedeutet, dass das Atom 17 Protonen im Kern und 17 Elektronen in der Elektronenhülle hat. Auf der Ebene 1 können nur 2 Elektronen vorhanden sein, auf der Ebene 3 - 7 Elektronen, da Chlor zur Hauptuntergruppe der Gruppe VII gehört. Dann gibt es auf Ebene 2: 17-2-7 = 8 Elektronen.
Sie müssen JavaScript aktivieren, um diese App auszuführen.Elektronische Konfiguration eines Atoms ist eine Formel, die die Anordnung der Elektronen in einem Atom nach Ebenen und Unterebenen zeigt. Nach dem Studium des Artikels erfahren Sie, wo und wie sich Elektronen befinden, lernen Quantenzahlen kennen und können die elektronische Konfiguration eines Atoms anhand seiner Anzahl konstruieren. Am Ende des Artikels finden Sie eine Tabelle der Elemente.
Warum die elektronische Konfiguration von Elementen studieren?
Atome sind wie ein Baukasten: Es gibt eine bestimmte Anzahl von Teilen, sie unterscheiden sich voneinander, aber zwei Teile des gleichen Typs sind absolut gleich. Aber dieser Baukasten ist viel interessanter als der aus Kunststoff und hier erfahren Sie, warum. Die Konfiguration ändert sich je nachdem, wer sich in der Nähe befindet. Zum Beispiel Sauerstoff neben Wasserstoff Vielleicht verwandelt sich in Wasser, in der Nähe von Natrium wird es zu Gas, und in der Nähe von Eisen verwandelt es sich vollständig in Rost. Um die Frage zu beantworten, warum dies geschieht, und um das Verhalten eines Atoms neben einem anderen vorherzusagen, ist es notwendig, die elektronische Konfiguration zu untersuchen, die weiter unten besprochen wird.
Wie viele Elektronen hat ein Atom?
Ein Atom besteht aus einem Kern und um ihn rotierenden Elektronen; der Kern besteht aus Protonen und Neutronen. Im neutralen Zustand hat jedes Atom so viele Elektronen wie Protonen in seinem Kern. Die Anzahl der Protonen wird durch die Ordnungszahl des Elements angegeben, zum Beispiel hat Schwefel 16 Protonen – das 16. Element des Periodensystems. Gold hat 79 Protonen – das 79. Element des Periodensystems. Demnach verfügt Schwefel im neutralen Zustand über 16 Elektronen, Gold über 79 Elektronen.
Wo sucht man nach einem Elektron?
Durch die Beobachtung des Verhaltens des Elektrons wurden bestimmte Muster abgeleitet; sie werden durch Quantenzahlen beschrieben, insgesamt gibt es vier:
- Hauptquantenzahl
- Orbitale Quantenzahl
- Magnetische Quantenzahl
- Spinquantenzahl
Orbital
Außerdem verwenden wir anstelle des Wortes „Orbital“ den Begriff „Orbital“; ein Orbital ist grob gesagt die Wellenfunktion eines Elektrons; es ist der Bereich, in dem sich das Elektron 90 % seiner Zeit verbringt.
N - Ebene
L – Schale
M l - Orbitalzahl
M s – erstes oder zweites Elektron im Orbital
Orbitalquantenzahl l
Als Ergebnis der Untersuchung der Elektronenwolke stellten sie fest, dass die Wolke je nach Energieniveau vier Hauptformen annimmt: eine Kugel, Hanteln und zwei weitere, komplexere Formen. In der Reihenfolge zunehmender Energie werden diese Formen als s-, p-, d- und f-Schale bezeichnet. Jede dieser Schalen kann 1 (auf s), 3 (auf p), 5 (auf d) und 7 (auf f) Orbitale haben. Die Orbitalquantenzahl ist die Hülle, in der sich die Orbitale befinden. Die Orbitalquantenzahl für die s-, p-, d- und f-Orbitale nimmt die Werte 0,1,2 bzw. 3 an.
Auf der S-Schale gibt es ein Orbital (L=0) – zwei Elektronen
Es gibt drei Orbitale auf der p-Schale (L=1) – sechs Elektronen
Es gibt fünf Orbitale auf der d-Schale (L=2) – zehn Elektronen
Es gibt sieben Orbitale auf der f-Schale (L=3) – vierzehn Elektronen
Magnetische Quantenzahl m l
Auf der p-Schale gibt es drei Orbitale, sie werden mit Zahlen von -L bis +L bezeichnet, d. h. für die p-Schale (L=1) gibt es die Orbitale „-1“, „0“ und „1“. . Die magnetische Quantenzahl wird mit dem Buchstaben m l bezeichnet.
Innerhalb der Schale ist es für Elektronen einfacher, sich in verschiedenen Orbitalen zu befinden, sodass die ersten Elektronen eines in jedem Orbital füllen und dann zu jedem ein Elektronenpaar hinzugefügt wird.
Betrachten Sie die D-Shell:
Die d-Schale entspricht dem Wert L=2, also fünf Orbitalen (-2,-1,0,1 und 2), die ersten fünf Elektronen füllen die Schale und nehmen die Werte M l =-2, M an l =-1, M l =0, M l =1, M l =2.
Spinquantenzahl m s
Spin ist die Drehrichtung eines Elektrons um seine Achse, es gibt zwei Richtungen, daher hat die Spinquantenzahl zwei Werte: +1/2 und -1/2. Eine Energieunterebene kann nur zwei Elektronen mit entgegengesetztem Spin enthalten. Die Spinquantenzahl wird mit m s bezeichnet
Hauptquantenzahl n
Die Hauptquantenzahl ist das Energieniveau; derzeit sind sieben Energieniveaus bekannt, die jeweils durch eine arabische Zahl angegeben werden: 1,2,3,...7. Die Anzahl der Granaten auf jeder Ebene entspricht der Levelnummer: Auf der ersten Ebene gibt es eine Muschel, auf der zweiten zwei usw.
Elektronenzahl

So kann jedes Elektron durch vier Quantenzahlen beschrieben werden, die Kombination dieser Zahlen ist für jede Position des Elektrons eindeutig, nimm das erste Elektron, das niedrigste Energieniveau ist N = 1, auf dem ersten Niveau gibt es eine Schale, die Die erste Schale auf jeder Ebene hat die Form einer Kugel (s-Schale), d. h. L=0, die magnetische Quantenzahl kann nur einen Wert annehmen, M l =0 und der Spin ist gleich +1/2. Wenn wir das fünfte Elektron nehmen (in welchem Atom auch immer es sich befindet), dann sind die Hauptquantenzahlen dafür: N=2, L=1, M=-1, Spin 1/2.
Die Struktur der elektronischen Hüllen von Atomen der Elemente der ersten vier Perioden: $s-$, $p-$ und $d-$Elemente. Elektronische Konfiguration eines Atoms. Grund- und angeregte Zustände von Atomen
Der Begriff Atom entstand in der Antike zur Bezeichnung von Materieteilchen. Aus dem Griechischen übersetzt bedeutet Atom „unteilbar“.
Elektronen
Der irische Physiker Stoney kam aufgrund von Experimenten zu dem Schluss, dass Elektrizität von den kleinsten Teilchen getragen wird, die in den Atomen aller chemischen Elemente vorkommen. Im Jahr 1891 schlug Herr Stoney vor, diese Teilchen zu benennen Elektronen, was auf Griechisch „Bernstein“ bedeutet.
Wenige Jahre nachdem das Elektron seinen Namen erhielt, bewiesen der englische Physiker Joseph Thomson und der französische Physiker Jean Perrin, dass Elektronen eine negative Ladung tragen. Dies ist die kleinste negative Ladung, die in der Chemie als Einheit $(–1)$ angenommen wird. Thomson gelang es sogar, die Geschwindigkeit des Elektrons (sie entspricht der Lichtgeschwindigkeit – 300.000 km/s) und die Masse des Elektrons (sie ist 1836-mal kleiner als die Masse eines Wasserstoffatoms) zu bestimmen.
Thomson und Perrin verbanden die Pole einer Stromquelle mit zwei Metallplatten – einer Kathode und einer Anode –, die in eine Glasröhre eingelötet waren, aus der die Luft evakuiert wurde. Wenn eine Spannung von etwa 10.000 Volt an die Elektrodenplatten angelegt wurde, blitzte eine leuchtende Entladung in der Röhre auf und Partikel flogen von der Kathode (Minuspol) zur Anode (Pluspol), wie die Wissenschaftler sie zuerst nannten Kathodenstrahlen, und fand dann heraus, dass es sich um einen Elektronenstrom handelte. Elektronen, die auf spezielle Substanzen treffen, beispielsweise auf einen Fernsehbildschirm, erzeugen ein Leuchten.
Die Schlussfolgerung wurde gezogen: Elektronen entweichen aus den Atomen des Materials, aus dem die Kathode besteht.
Freie Elektronen oder deren Fluss können auf andere Weise erhalten werden, beispielsweise durch Erhitzen eines Metalldrahts oder durch Bestrahlen von Metallen, die aus Elementen der Hauptnebengruppe der Gruppe I des Periodensystems (z. B. Cäsium) bestehen.
Zustand der Elektronen in einem Atom
Unter dem Zustand eines Elektrons in einem Atom versteht man die Gesamtheit der Informationen darüber Energie bestimmtes Elektron hinein Raum, in dem es sich befindet. Wir wissen bereits, dass ein Elektron in einem Atom keine Bewegungsbahn hat, d. h. wir können nur darüber reden Wahrscheinlichkeiten seine Lage im Raum um den Kern. Es kann sich in jedem Teil dieses den Kern umgebenden Raums befinden, und die Menge verschiedener Positionen wird als Elektronenwolke mit einer bestimmten negativen Ladungsdichte betrachtet. Im übertragenen Sinne kann man sich das so vorstellen: Wenn es möglich wäre, die Position eines Elektrons in einem Atom nach Hundertstel oder Millionstel einer Sekunde zu fotografieren, wie bei einem Fotofinish, dann würde das Elektron auf solchen Fotografien als Punkt dargestellt. Würde man zahllose solcher Aufnahmen überlagern, ergäbe das Bild eine Elektronenwolke mit der größten Dichte dort, wo sich die meisten dieser Punkte befinden.
Die Abbildung zeigt einen „Schnitt“ einer solchen Elektronendichte in einem Wasserstoffatom, das den Kern passiert, und die gestrichelte Linie begrenzt den Bereich, in dem die Wahrscheinlichkeit, ein Elektron zu entdecken, 90 % beträgt. Die Kontur, die dem Kern am nächsten liegt, deckt einen Raumbereich ab, in dem die Wahrscheinlichkeit, ein Elektron zu entdecken, 10 % beträgt. Die Wahrscheinlichkeit, ein Elektron innerhalb der zweiten Kontur vom Kern aus zu entdecken, beträgt 20 % und innerhalb der dritten Kontur beträgt sie ≈30 %. $ usw. Es besteht eine gewisse Unsicherheit über den Zustand des Elektrons. Um diesen Sonderzustand zu charakterisieren, führte der deutsche Physiker W. Heisenberg den Begriff ein Unschärferelation, d.h. zeigte, dass es unmöglich ist, gleichzeitig und genau die Energie und den Ort eines Elektrons zu bestimmen. Je genauer die Energie eines Elektrons bestimmt wird, desto unsicherer ist seine Position, und umgekehrt ist es nach der Positionsbestimmung unmöglich, die Energie des Elektrons zu bestimmen. Der Wahrscheinlichkeitsbereich für den Nachweis eines Elektrons hat keine klaren Grenzen. Es ist jedoch möglich, einen Raum auszuwählen, in dem die Wahrscheinlichkeit, ein Elektron zu finden, am größten ist.
Der Raum um den Atomkern, in dem sich ein Elektron am wahrscheinlichsten aufhält, wird Orbital genannt.

Es enthält etwa 90 % der Elektronenwolke, was bedeutet, dass sich das Elektron etwa 90 % der Zeit in diesem Teil des Raums aufhält. Aufgrund ihrer Form sind vier Arten von Orbitalen bekannt, die mit den lateinischen Buchstaben $s, p, d$ und $f$ bezeichnet werden. Eine grafische Darstellung einiger Formen von Elektronenorbitalen ist in der Abbildung dargestellt.

Das wichtigste Merkmal der Bewegung eines Elektrons in einem bestimmten Orbital ist die Energie seiner Bindung an den Kern. Elektronen mit ähnlichen Energiewerten bilden eine Einheit Elektronenschicht, oder Energielevel. Die Energieniveaus werden ausgehend vom Kern nummeriert: 1 $, 2, 3, 4, 5, 6 $ und 7 $.
Die ganze Zahl $n$, die die Zahl des Energieniveaus angibt, wird Hauptquantenzahl genannt.
Es charakterisiert die Energie von Elektronen, die ein bestimmtes Energieniveau einnehmen. Elektronen des ersten Energieniveaus, das dem Kern am nächsten liegt, haben die niedrigste Energie. Im Vergleich zu Elektronen der ersten Ebene zeichnen sich Elektronen nachfolgender Ebenen durch eine große Energiemenge aus. Folglich sind die Elektronen der äußeren Ebene am wenigsten fest an den Atomkern gebunden.
Die Anzahl der Energieniveaus (elektronischen Schichten) in einem Atom entspricht der Anzahl der Perioden im D.I. Mendelejew-System, zu dem das chemische Element gehört: Atome von Elementen der ersten Periode haben ein Energieniveau; zweite Periode - zwei; siebte Periode - sieben.
Die größte Elektronenzahl auf einem Energieniveau wird durch die Formel bestimmt:
wobei $N$ die maximale Anzahl an Elektronen ist; $n$ ist die Stufenzahl oder die Hauptquantenzahl. Folglich: Auf dem ersten Energieniveau, das dem Kern am nächsten liegt, können nicht mehr als zwei Elektronen vorhanden sein; beim zweiten - nicht mehr als 8$; am dritten – nicht mehr als 18 $; am vierten - nicht mehr als 32$. Und wie wiederum sind die Energieniveaus (elektronische Schichten) angeordnet?
Ausgehend vom zweiten Energieniveau $(n = 2)$ ist jedes der Niveaus in Unterniveaus (Unterschichten) unterteilt, die sich in der Bindungsenergie mit dem Kern geringfügig voneinander unterscheiden.
Die Anzahl der Unterebenen entspricht dem Wert der Hauptquantenzahl: die erste Energieebene hat eine Unterebene; der zweite - zwei; dritter - drei; vierter - vier. Unterebenen wiederum werden durch Orbitale gebildet.
Jeder Wert von $n$ entspricht einer Anzahl von Orbitalen, die $n^2$ entspricht. Anhand der in der Tabelle dargestellten Daten kann man den Zusammenhang zwischen der Hauptquantenzahl $n$ und der Anzahl der Unterebenen, der Art und Anzahl der Orbitale sowie der maximalen Anzahl von Elektronen auf der Unterebene und Ebene nachvollziehen.
Hauptquantenzahl, Arten und Anzahl der Orbitale, maximale Elektronenzahl in Unterebenen und Ebenen.
| Energieniveau $(n)$ | Anzahl der Unterebenen gleich $n$ | Orbitaler Typ | Anzahl der Orbitale | Maximale Anzahl an Elektronen | ||
| in der Unterebene | in der Ebene gleich $n^2$ | in der Unterebene | auf einem Niveau gleich $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| 2 Pence $ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| 3 Pence $ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| 4 Pence $ | $3$ | $6$ | ||||
| 4d$ | $5$ | $10$ | ||||
| 4f$ | $7$ | $14$ | ||||
Unterebenen werden üblicherweise durch lateinische Buchstaben sowie die Form der Orbitale, aus denen sie bestehen, bezeichnet: $s, p, d, f$. Also:
- $s$-Unterniveau – das erste Unterniveau jedes Energieniveaus, das dem Atomkern am nächsten liegt, besteht aus einem $s$-Orbital;
- $p$-Unterebene – die zweite Unterebene jedes Energieniveaus, außer der ersten, besteht aus drei $p$-Orbitalen;
- $d$-Unterebene – die dritte Unterebene von jedem, beginnend mit der dritten Energieebene, besteht aus fünf $d$-Orbitalen;
- Das $f$-Unterniveau jedes einzelnen, beginnend mit dem vierten Energieniveau, besteht aus sieben $f$-Orbitalen.
Atomkern
Aber nicht nur Elektronen sind Teil von Atomen. Der Physiker Henri Becquerel entdeckte, dass ein natürliches Mineral, das ein Uransalz enthält, ebenfalls unbekannte Strahlung aussendet und so lichtgeschützte Fotofilme freilegt. Dieses Phänomen wurde genannt Radioaktivität.
Es gibt drei Arten radioaktiver Strahlen:
- $α$-Strahlen, die aus $α$-Teilchen bestehen, deren Ladung $2$-mal größer ist als die Ladung eines Elektrons, aber ein positives Vorzeichen hat, und eine Masse $4$-mal größer als die Masse eines Wasserstoffatoms;
- $β$-Strahlen stellen einen Elektronenfluss dar;
- $γ$-Strahlen sind elektromagnetische Wellen mit vernachlässigbarer Masse, die keine elektrische Ladung tragen.
Folglich hat das Atom eine komplexe Struktur – es besteht aus einem positiv geladenen Kern und Elektronen.
Wie ist das Atom aufgebaut?
Im Jahr 1910 untersuchten Ernest Rutherford und seine Studenten und Kollegen in Cambridge in der Nähe von London die Streuung von $α$-Partikeln, die durch dünne Goldfolie hindurchgehen und auf einen Bildschirm fallen. Alpha-Teilchen wichen normalerweise nur um ein Grad von der ursprünglichen Richtung ab, was scheinbar die Einheitlichkeit und Einheitlichkeit der Eigenschaften von Goldatomen bestätigt. Und plötzlich bemerkten die Forscher, dass einige $α$-Teilchen abrupt die Richtung ihrer Bahn änderten, als ob sie auf ein Hindernis stoßen würden.
Durch die Platzierung eines Schirms vor der Folie konnte Rutherford sogar die seltenen Fälle erkennen, in denen von Goldatomen reflektierte $α$-Partikel in die entgegengesetzte Richtung flogen.
Berechnungen zeigten, dass die beobachteten Phänomene auftreten könnten, wenn die gesamte Masse des Atoms und seine gesamte positive Ladung in einem winzigen zentralen Kern konzentriert wären. Wie sich herausstellte, ist der Radius des Kerns 100.000-mal kleiner als der Radius des gesamten Atoms, dem Bereich, in dem sich negativ geladene Elektronen befinden. Wenn wir einen bildlichen Vergleich anwenden, kann das gesamte Volumen eines Atoms mit dem Stadion in Luschniki verglichen werden, und der Kern kann mit einem Fußball verglichen werden, der sich in der Mitte des Spielfelds befindet.
Ein Atom eines beliebigen chemischen Elements ist vergleichbar mit einem winzigen Sonnensystem. Daher wird dieses von Rutherford vorgeschlagene Atommodell als planetarisch bezeichnet.
Protonen und Neutronen
Es stellt sich heraus, dass der winzige Atomkern, in dem die gesamte Atommasse konzentriert ist, aus zwei Arten von Teilchen besteht – Protonen und Neutronen.
Protonen haben eine Ladung, die der Ladung der Elektronen entspricht, aber das entgegengesetzte Vorzeichen $(+1)$ hat, und eine Masse, die der Masse des Wasserstoffatoms entspricht (sie wird in der Chemie als Einheit angenommen). Protonen werden mit dem Zeichen $↙(1)↖(1)p$ (oder $p+$) bezeichnet. Neutronen tragen keine Ladung, sind neutral und haben eine Masse, die der Masse eines Protons entspricht, d.h. 1 $. Neutronen werden mit dem Zeichen $↙(0)↖(1)n$ (oder $n^0$) bezeichnet.
Man nennt Protonen und Neutronen zusammen Nukleonen(von lat. Kern- Kern).
Man nennt die Summe der Anzahl der Protonen und Neutronen in einem Atom Massenzahl. Die Massenzahl eines Aluminiumatoms beträgt beispielsweise:

Da die vernachlässigbar kleine Masse des Elektrons vernachlässigt werden kann, liegt es auf der Hand, dass die gesamte Masse des Atoms im Kern konzentriert ist. Elektronen werden wie folgt bezeichnet: $e↖(-)$.
Da das Atom elektrisch neutral ist, ist das auch offensichtlich dass die Anzahl der Protonen und Elektronen in einem Atom gleich ist. Sie entspricht der Ordnungszahl des chemischen Elements, ihm im Periodensystem zugeordnet. Beispielsweise enthält der Kern eines Eisenatoms 26 $ Protonen, und 26 $ Elektronen kreisen um den Kern. Wie bestimmt man die Anzahl der Neutronen?
Die Masse eines Atoms besteht bekanntlich aus der Masse der Protonen und Neutronen. Kenntnis der Seriennummer des Elements $(Z)$, d.h. die Anzahl der Protonen und die Massenzahl $(A)$, gleich der Summe der Anzahlen von Protonen und Neutronen, die Anzahl der Neutronen $(N)$ kann mit der Formel ermittelt werden:
Die Anzahl der Neutronen in einem Eisenatom beträgt beispielsweise:
$56 – 26 = 30$.
Die Tabelle stellt die Haupteigenschaften von Elementarteilchen dar.
Grundlegende Eigenschaften von Elementarteilchen.
Isotope
Sorten von Atomen desselben Elements, die die gleiche Kernladung, aber unterschiedliche Massenzahlen haben, werden Isotope genannt.
Wort Isotop besteht aus zwei griechischen Wörtern: Isos- identisch und Topos- Ort bedeutet „einen Platz“ (Zelle) im Periodensystem der Elemente einnehmen.
In der Natur vorkommende chemische Elemente sind eine Mischung aus Isotopen. Somit hat Kohlenstoff drei Isotope mit den Massen $12, 13, 14$; Sauerstoff – drei Isotope mit den Massen $16, 17, 18 usw.
Normalerweise ist die im Periodensystem angegebene relative Atommasse eines chemischen Elements der Durchschnittswert der Atommassen einer natürlichen Isotopenmischung eines bestimmten Elements unter Berücksichtigung ihrer relativen Häufigkeit in der Natur, also der Atomwerte Massen sind oft gebrochen. Beispielsweise sind natürliche Chloratome eine Mischung aus zwei Isotopen – $35$ (in der Natur kommen sie zu 75%$ vor) und $37$ (in der Natur kommen sie zu 25%$ vor); Daher beträgt die relative Atommasse von Chlor 35,5 $. Chlorisotope werden wie folgt geschrieben:
$↖(35)↙(17)(Cl)$ und $↖(37)↙(17)(Cl)$
Die chemischen Eigenschaften von Chlorisotopen sind genau die gleichen, ebenso wie die Isotope der meisten chemischen Elemente, zum Beispiel Kalium, Argon:
$↖(39)↙(19)(K)$ und $↖(40)↙(19)(K)$, $↖(39)↙(18)(Ar)$ und $↖(40)↙(18 )(Ar)$
Allerdings variieren die Eigenschaften von Wasserstoffisotopen aufgrund der dramatischen mehrfachen Zunahme ihrer relativen Atommasse stark; Sie erhielten sogar individuelle Namen und chemische Symbole: Protium - $↖(1)↙(1)(H)$; Deuterium - $↖(2)↙(1)(H)$, oder $↖(2)↙(1)(D)$; Tritium - $↖(3)↙(1)(H)$, oder $↖(3)↙(1)(T)$.

Jetzt können wir eine moderne, strengere und wissenschaftlichere Definition eines chemischen Elements geben.
Ein chemisches Element ist eine Ansammlung von Atomen mit derselben Kernladung.
Die Struktur der elektronischen Hüllen der Atome der Elemente der ersten vier Perioden
Betrachten wir die Darstellung elektronischer Konfigurationen von Elementatomen gemäß den Perioden des D.I. Mendeleev-Systems.
Elemente der ersten Periode.
Diagramme der elektronischen Struktur von Atomen zeigen die Verteilung der Elektronen über elektronische Schichten (Energieniveaus).

Elektronische Formeln von Atomen zeigen die Verteilung von Elektronen über Energieniveaus und Unterniveaus.
Grafische elektronische Formeln von Atomen zeigen die Verteilung von Elektronen nicht nur über Ebenen und Unterebenen, sondern auch über Orbitale.

In einem Heliumatom ist die erste Elektronenschicht vollständig – sie enthält $2$ Elektronen.
Wasserstoff und Helium sind $s$-Elemente; das $s$-Orbital dieser Atome ist mit Elektronen gefüllt.
Elemente der zweiten Periode.
Für alle Elemente der zweiten Periode ist die erste Elektronenschicht gefüllt, und Elektronen füllen die $s-$- und $p$-Orbitale der zweiten Elektronenschicht gemäß dem Prinzip der geringsten Energie (zuerst $s$ und dann $p$). ) und die Pauli- und Hund-Regeln.
Im Neonatom ist die zweite Elektronenschicht vollständig – sie enthält $8$-Elektronen.
Elemente der dritten Periode.
Für Atome von Elementen der dritten Periode werden die erste und zweite Elektronenschicht vervollständigt, sodass die dritte Elektronenschicht gefüllt wird, in der Elektronen die 3s-, 3p- und 3d-sub-Ebenen besetzen können.
Die Struktur der elektronischen Hüllen der Atome der Elemente der dritten Periode.
Das Magnesiumatom vervollständigt sein $3,5$-Elektronenorbital. $Na$ und $Mg$ sind $s$-Elemente.
In Aluminium und nachfolgenden Elementen ist die $3d$-Unterebene mit Elektronen gefüllt.
| $↙(18)(Ar)$ Argon |  |
$1s^2(2)s^2(2)p^6(3)s^2(3)p^6$ |  |
Ein Argonatom hat $8$-Elektronen in seiner äußeren Schicht (dritte Elektronenschicht). Wenn die äußere Schicht fertig ist, können sich in der dritten Elektronenschicht, wie Sie bereits wissen, insgesamt 18 Elektronen befinden, was bedeutet, dass die Elemente der dritten Periode unbefüllte $3d$-Orbitale haben.
Alle Elemente von $Al$ bis $Ar$ sind $ð$ -Elemente.
$s-$ und $p$ -Elemente bilden Hauptuntergruppen im Periodensystem.
Elemente der vierten Periode.
Kalium- und Kalziumatome haben eine vierte Elektronenschicht und die $4s$-Unterebene ist gefüllt, weil es hat eine geringere Energie als die $3d$-Unterebene. Um die grafischen elektronischen Formeln der Atome der Elemente der vierten Periode zu vereinfachen:
- Bezeichnen wir die herkömmliche grafische elektronische Formel von Argon wie folgt: $Ar$;
- Wir werden keine Unterebenen darstellen, die nicht mit diesen Atomen gefüllt sind.
$K, Ca$ - $s$ -Elemente, in den Hauptuntergruppen enthalten. Für Atome von $Sc$ bis $Zn$ ist die 3D-Unterebene mit Elektronen gefüllt. Dies sind $3d$-Elemente. Sie sind darin enthalten Nebenuntergruppen, Ihre äußere Elektronenschicht ist gefüllt, sie werden klassifiziert als Übergangselemente.
Achten Sie auf die Struktur der elektronischen Hüllen von Chrom- und Kupferatomen. In ihnen „fällt“ ein Elektron von der $4s-$- auf die $3d$-Unterebene, was durch die größere Energiestabilität der resultierenden elektronischen Konfigurationen $3d^5$ und $3d^(10)$ erklärt wird:
$↙(24)(Cr)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(4) 4s^(2)…$ 
$↙(29)(Cu)$ $1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)3d^(9)4s^(2)…$ 
| Elementsymbol, Seriennummer, Name | Elektronisches Strukturdiagramm | Elektronische Formel | Grafische elektronische Formel |
| $↙(19)(K)$ Kalium |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1$ | |
| $↙(20)(C)$ Kalzium |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2$ | |
| $↙(21)(Sc)$ Scandium |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^1$ oder $1s^2(2)s^2(2)p ^6(3)p^6(3)d^1(4)s^1$ |  |
| $↙(22)(Ti)$ Titan |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^2$ oder $1s^2(2)s^2(2)p ^6(3)p^6(3)d^2(4)s^2$ |  |
| $↙(23)(V)$ Vanadium |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^3$ oder $1s^2(2)s^2(2)p ^6(3)p^6(3)d^3(4)s^2$ |  |
| $↙(24)(Cr)$ Chrom |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^5$ oder $1s^2(2)s^2(2)p ^6(3)p^6(3)d^5(4)s^1$ |  |
| $↙(29)(Cu)$ Chrom |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^1(3)d^(10)$ oder $1s^2(2)s^2(2 )p^6(3)p^6(3)d^(10)(4)s^1$ |  |
| $↙(30)(Zn)$ Zink |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)$ oder $1s^2(2)s^2(2 )p^6(3)p^6(3)d^(10)(4)s^2$ |  |
| $↙(31)(Ga)$ Gallium |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^(1)$ oder $1s^2(2) s^2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^(1)$ |  |
| $↙(36)(Kr)$ Krypton |  |
$1s^2(2)s^2(2)p^6(3)p^6(4)s^2(3)d^(10)4p^6$ oder $1s^2(2)s^ 2(2)p^6(3)p^6(3)d^(10)(4)s^(2)4p^6$ |  |
Im Zinkatom ist die dritte Elektronenschicht vollständig – alle $3s-, 3p$- und $3d$-Unterebenen sind darin gefüllt, mit insgesamt $18$-Elektronen.
In den auf Zink folgenden Elementen ist die vierte Elektronenschicht, die $4p$-Unterebene, weiterhin gefüllt. Elemente von $Ga$ bis $Кr$ - $ð$ -Elemente.
Die äußere (vierte) Schicht des Kryptonatoms ist vollständig und hat $8$-Elektronen. Aber insgesamt kann es in der vierten Elektronenschicht, wie Sie wissen, $32$-Elektronen geben; Das Kryptonatom hat immer noch unbefüllte $4d-$- und $4f$-Unterebenen.
Für Elemente der fünften Periode werden Unterebenen in der folgenden Reihenfolge ausgefüllt: $5s → 4d → 5p$. Und es gibt auch Ausnahmen, die mit dem „Versagen“ von Elektronen in $↙(41)Nb$, $↙(42)Mo$, $↙(44)Ru$, $↙(45)Rh$, $↙(46) verbunden sind ) Pd$, $↙(47)Ag$. $f$ erscheint in der sechsten und siebten Periode -Elemente, d.h. Elemente, für die die Unterebenen $4f-$ und $5f$ der dritten äußeren elektronischen Schicht gefüllt sind.
4f$ -Elemente angerufen Lanthanoide.
5f$ -Elemente angerufen Aktiniden.
Die Reihenfolge der Füllung elektronischer Unterebenen in Atomen von Elementen der sechsten Periode: $↙(55)Cs$ und $↙(56)Ba$ - $6s$ Elemente; $↙(57)La ... 6s^(2)5d^(1)$ - $5d$-Element; $↙(58)Се$ – $↙(71)Lu - 4f$-Elemente; $↙(72)Hf$ – $↙(80)Hg - 5d$-Elemente; $↙(81)T1$ – $↙(86)Rn - 6d$-Elemente. Aber auch hier gibt es Elemente, bei denen die Reihenfolge der Füllung elektronischer Orbitale verletzt wird, was beispielsweise mit einer größeren Energiestabilität halber und vollständig gefüllter $f$-Unterniveaus verbunden ist, d. h. $nf^7$ und $nf^(14)$.
Je nachdem, welche Unterebene des Atoms zuletzt mit Elektronen gefüllt ist, werden alle Elemente, wie Sie bereits verstanden haben, in vier Elektronenfamilien oder Blöcke unterteilt:
- $s$ -Elemente; die $s$-Unterebene der äußeren Ebene des Atoms ist mit Elektronen gefüllt; Zu den $s$-Elementen gehören Wasserstoff, Helium und Elemente der Hauptuntergruppen der Gruppen I und II;
- $p$ -Elemente; die $p$-Unterebene der äußeren Ebene des Atoms ist mit Elektronen gefüllt; $p$-Elemente umfassen Elemente der Hauptuntergruppen der Gruppen III–VIII;
- $d$ -Elemente; die $d$-Unterebene der voräußeren Ebene des Atoms ist mit Elektronen gefüllt; $d$-Elemente umfassen Elemente sekundärer Untergruppen der Gruppen I–VIII, d. h. Elemente interkalarer Jahrzehnte großer Perioden, die zwischen $s-$- und $p-$-Elementen liegen. Sie werden auch genannt Übergangselemente;
- $f$ -Elemente; Elektronen füllen die $f-$Unterebene der dritten äußeren Ebene des Atoms; Dazu gehören Lanthaniden und Aktiniden.

Elektronische Konfiguration eines Atoms. Grund- und angeregte Zustände von Atomen
Das fand der Schweizer Physiker W. Pauli im Jahr 1925 heraus Ein Atom kann nicht mehr als zwei Elektronen in einem Orbital haben, mit entgegengesetzten (antiparallelen) Rücken (aus dem Englischen übersetzt als Spindel), d. h. Eigenschaften besitzen, die man sich herkömmlicherweise als die Drehung eines Elektrons um seine imaginäre Achse im oder gegen den Uhrzeigersinn vorstellen kann. Dieses Prinzip heißt Pauli-Prinzip.
Befindet sich in einem Orbital ein Elektron, wird es aufgerufen ungepaart, wenn zwei, dann das gepaarte Elektronen, d.h. Elektronen mit entgegengesetztem Spin.
Die Abbildung zeigt ein Diagramm zur Aufteilung der Energieniveaus in Unterniveaus.

$s-$ Orbital, wie Sie bereits wissen, hat eine Kugelform. Das Elektron des Wasserstoffatoms $(n = 1)$ befindet sich in diesem Orbital und ist ungepaart. Aus diesem Grund ist es elektronische Formel, oder elektronische Konfiguration wird wie folgt geschrieben: $1s^1$. In elektronischen Formeln wird die Zahl des Energieniveaus durch die Zahl vor dem Buchstaben $(1...)$ angegeben, der lateinische Buchstabe bezeichnet das Unterniveau (Art des Orbitals) und die Zahl rechts darüber steht Der Buchstabe (als Exponent) gibt die Anzahl der Elektronen in der Unterebene an.
Für ein Heliumatom He, das zwei gepaarte Elektronen in einem $s-$orbital hat, lautet diese Formel: $1s^2$. Die Elektronenhülle des Heliumatoms ist vollständig und sehr stabil. Helium ist ein Edelgas. Auf dem zweiten Energieniveau $(n = 2)$ gibt es vier Orbitale, ein $s$ und drei $p$. Elektronen des $s$-Orbitals der zweiten Ebene ($2s$-Orbital) haben eine höhere Energie, weil sind vom Kern weiter entfernt als die Elektronen des $1s$-Orbitals $(n = 2)$. Im Allgemeinen gibt es für jeden Wert von $n$ ein $s-$Orbital, jedoch mit einem entsprechenden Vorrat an Elektronenenergie und daher mit einem entsprechenden Durchmesser, der mit zunehmendem Wert von $n$ wächst s-$Orbital hat, wie Sie bereits wissen, eine Kugelform. Das Elektron des Wasserstoffatoms $(n = 1)$ befindet sich in diesem Orbital und ist ungepaart. Daher wird seine elektronische Formel oder elektronische Konfiguration wie folgt geschrieben: $1s^1$. In elektronischen Formeln wird die Zahl des Energieniveaus durch die Zahl vor dem Buchstaben $(1...)$ angegeben, der lateinische Buchstabe bezeichnet das Unterniveau (Art des Orbitals) und die Zahl rechts darüber steht Der Buchstabe (als Exponent) gibt die Anzahl der Elektronen in der Unterebene an.
Für ein Heliumatom $He$, das zwei gepaarte Elektronen in einem $s-$orbital hat, lautet diese Formel: $1s^2$. Die Elektronenhülle des Heliumatoms ist vollständig und sehr stabil. Helium ist ein Edelgas. Auf dem zweiten Energieniveau $(n = 2)$ gibt es vier Orbitale, ein $s$ und drei $p$. Elektronen von $s-$-Orbitalen der zweiten Ebene ($2s$-Orbitale) haben eine höhere Energie, weil sind vom Kern weiter entfernt als die Elektronen des $1s$-Orbitals $(n = 2)$. Im Allgemeinen gibt es für jeden Wert von $n$ ein $s-$Orbital, jedoch mit einem entsprechenden Vorrat an Elektronenenergie und daher mit einem entsprechenden Durchmesser, der mit zunehmendem Wert von $n$ wächst. 
$p-$ Orbital hat die Form einer Hantel oder einer voluminösen Acht. Alle drei $p$-Orbitale stehen im Atom senkrecht zueinander entlang der durch den Atomkern gezogenen Raumkoordinaten. Es sei noch einmal betont, dass jedes Energieniveau (elektronische Schicht), beginnend mit $n= 2$, drei $p$-Orbitale besitzt. Wenn der Wert von $n$ zunimmt, besetzen Elektronen $p$-Orbitale, die sich in großer Entfernung vom Kern befinden und entlang der $x-, y-, z$-Achsen ausgerichtet sind.
Für Elemente der zweiten Periode $(n = 2)$ wird zunächst ein $s$-Orbital gefüllt, dann drei $p$-Orbitale; elektronische Formel $Li: 1s^(2)2s^(1)$. Das Elektron $2s^1$ ist schwächer an den Atomkern gebunden, sodass das Lithiumatom es leicht abgeben kann (wie Sie sich sicher erinnern, nennt man diesen Vorgang Oxidation) und sich in ein Lithiumion $Li^+$ verwandelt .
Im Beryllium-Be-Atom befindet sich das vierte Elektron ebenfalls im $2s$-Orbital: $1s^(2)2s^(2)$. Die beiden äußeren Elektronen des Berylliumatoms werden leicht abgetrennt – $B^0$ wird zum Kation $Be^(2+)$ oxidiert.
Im Boratom besetzt das fünfte Elektron das $2p$-Orbital: $1s^(2)2s^(2)2p^(1)$. Als nächstes werden die $C-, N-, O-, F$-Atome mit $2p$-Orbitalen gefüllt, was mit dem Edelgas Neon endet: $1s^(2)2s^(2)2p^(6)$.
Für Elemente der dritten Periode sind die Orbitale $3s-$ und $3p$ gefüllt. Fünf $d$-Orbitale der dritten Ebene bleiben frei:
$↙(11)Na 1s^(2)2s^(2)2p^(6)3s^(1)$,
$↙(17)Cl 1s^(2)2s^(2)2p^(6)3s^(2)3p^(5)$,
$↙(18)Ar 1s^(2)2s^(2)2p^(6)3s^(2)3p^(6)$.
Manchmal wird in Diagrammen, die die Verteilung von Elektronen in Atomen darstellen, nur die Anzahl der Elektronen auf jedem Energieniveau angegeben, d. h. Schreiben Sie abgekürzte elektronische Formeln von Atomen chemischer Elemente im Gegensatz zu den oben angegebenen vollständigen elektronischen Formeln, zum Beispiel:
$↙(11)Na 2, 8, 1;$ $↙(17)Cl 2, 8, 7;$ $↙(18)Ar 2, 8, 8$.
Für Elemente großer Perioden (vierte und fünfte) besetzen die ersten beiden Elektronen $4s-$- bzw. $5s$-Orbitale: $↙(19)K 2, 8, 8, 1;$ $↙(38)Sr 2 , 8, 18, 8, 2$. Beginnend mit dem dritten Element jeder Hauptperiode wandern die nächsten zehn Elektronen zu den vorherigen $3d-$- bzw. $4d-$-Orbitalen (für Elemente von Seitenuntergruppen): $↙(23)V 2, 8, 11 , 2;$ $↙( 26)Fr 2, 8, 14, 2;$ $↙(40)Zr 2, 8, 18, 10, 2;$ $↙(43)Tc 2, 8, 18, 13, 2$. Wenn die vorherige $d$-Unterebene gefüllt ist, beginnt in der Regel die äußere ($4ð-$ bzw. $5ð-$) $ð-$-Unterebene zu füllen: $↙(33)As 2, 8 , 18, 5;$ $ ↙(52)Te 2, 8, 18, 18, 6$.
Bei Elementen großer Perioden – der sechsten und der unvollständigen siebten – werden elektronische Ebenen und Unterebenen in der Regel wie folgt mit Elektronen gefüllt: Die ersten beiden Elektronen treten in die äußere $s-$Unterebene ein: $↙(56)Ba 2, 8, 18, 18, 8, 2;$ $↙(87)Fr 2, 8, 18, 32, 18, 8, 1$; das nächste Elektron (für $La$ und $Ca$) zur vorherigen $d$-Unterebene: $↙(57)La 2, 8, 18, 18, 9, 2$ und $↙(89)Ac 2, 8, 18, 32, 18, 9, 2$.
Dann wandern die nächsten $14$-Elektronen auf das dritte äußere Energieniveau, zu den $4f$- und $5f$-Orbitalen der Lanthanoiden bzw. Actiniden: $↙(64)Gd 2, 8, 18, 25, 9, 2; $ $↙(92 )U 2, 8, 18, 32, 21, 9, 2$.
Dann beginnt sich das zweite äußere Energieniveau ($d$-Unterniveau) der Elemente der Nebenuntergruppen wieder aufzubauen: $↙(73)Ta 2, 8, 18, 32, 11, 2;$ $↙(104)Rf 2, 8, 18, 32, 32, 10, 2$. Und schließlich wird das $p$-Unterniveau erst dann wieder gefüllt, wenn das $d$-Unterniveau vollständig mit zehn Elektronen gefüllt ist: $↙(86)Rn 2, 8, 18, 32, 18, 8$.
Sehr oft wird der Aufbau der elektronischen Hüllen von Atomen mithilfe von Energie- oder Quantenzellen – den sogenannten – dargestellt grafische elektronische Formeln. Für diese Notation wird die folgende Notation verwendet: Jede Quantenzelle wird durch eine Zelle bezeichnet, die einem Orbital entspricht; Jedes Elektron ist durch einen Pfeil gekennzeichnet, der der Spinrichtung entspricht. Beim Schreiben einer grafischen elektronischen Formel sollten Sie zwei Regeln beachten: Pauli-Prinzip, wonach es in einer Zelle (Orbital) nicht mehr als zwei Elektronen geben darf, jedoch mit antiparallelen Spins, und F. Hunds Regel, wonach Elektronen freie Zellen zunächst einzeln besetzen und den gleichen Spinwert haben und sich erst dann paaren, die Spins jedoch nach dem Pauli-Prinzip in entgegengesetzte Richtungen verlaufen.
Es wird in Form sogenannter elektronischer Formeln geschrieben. In elektronischen Formeln bezeichnen die Buchstaben s, p, d, f die Energieunterniveaus von Elektronen; Die Zahlen vor den Buchstaben geben das Energieniveau an, in dem sich ein bestimmtes Elektron befindet, und der Index oben rechts gibt die Anzahl der Elektronen in einem bestimmten Unterniveau an. Um die elektronische Formel eines Atoms eines beliebigen Elements zusammenzustellen, reicht es aus, die Nummer dieses Elements im Periodensystem zu kennen und die Grundprinzipien zu befolgen, die die Verteilung der Elektronen im Atom bestimmen.
Der Aufbau der Elektronenhülle eines Atoms lässt sich auch in Form eines Diagramms der Anordnung der Elektronen in Energiezellen darstellen.
Für Eisenatome hat dieses Schema die folgende Form:
Dieses Diagramm zeigt deutlich die Umsetzung der Hundschen Regel. Auf der 3D-Unterebene ist die maximale Anzahl an Zellen (vier) mit ungepaarten Elektronen gefüllt. Das Bild der Struktur der Elektronenhülle in einem Atom in Form elektronischer Formeln und in Form von Diagrammen spiegelt die Welleneigenschaften des Elektrons nicht eindeutig wider.
Der Wortlaut des Periodengesetzes in der geänderten Fassung JA. Mendelejew : Die Eigenschaften einfacher Körper sowie die Formen und Eigenschaften von Elementverbindungen stehen in einer periodischen Abhängigkeit von der Größe der Atomgewichte der Elemente.
Moderne Formulierung des Periodengesetzes: Die Eigenschaften von Elementen sowie die Formen und Eigenschaften ihrer Verbindungen hängen periodisch von der Größe der Ladung des Kerns ihrer Atome ab.
Somit erwies sich die positive Ladung des Kerns (und nicht die Atommasse) als genaueres Argument, von dem die Eigenschaften von Elementen und ihren Verbindungen abhängen
Wertigkeit- Dies ist die Anzahl der chemischen Bindungen, durch die ein Atom mit einem anderen verbunden ist.
Die Valenzfähigkeiten eines Atoms werden durch die Anzahl ungepaarter Elektronen und das Vorhandensein freier Atomorbitale auf der äußeren Ebene bestimmt. Die Struktur der äußeren Energieniveaus der Atome chemischer Elemente bestimmt maßgeblich die Eigenschaften ihrer Atome. Daher werden diese Ebenen Valenzniveaus genannt. Elektronen dieser Ebenen und manchmal auch der vorexternen Ebenen können an der Bildung chemischer Bindungen beteiligt sein. Solche Elektronen werden auch Valenzelektronen genannt.
Stöchiometrische Valenz Chemisches Element - Dies ist die Anzahl der Äquivalente, die ein bestimmtes Atom an sich selbst binden kann, oder die Anzahl der Äquivalente in einem Atom.
Äquivalente werden durch die Anzahl der gebundenen oder substituierten Wasserstoffatome bestimmt, sodass die stöchiometrische Wertigkeit gleich der Anzahl der Wasserstoffatome ist, mit denen ein bestimmtes Atom interagiert. Aber nicht alle Elemente interagieren frei, aber fast alle interagieren mit Sauerstoff, sodass die stöchiometrische Wertigkeit als die doppelte Anzahl der gebundenen Sauerstoffatome definiert werden kann.
Beispielsweise beträgt die stöchiometrische Wertigkeit von Schwefel in Schwefelwasserstoff H 2 S 2, in Oxid SO 2 - 4, in Oxid SO 3 -6.
Bei der Bestimmung der stöchiometrischen Wertigkeit eines Elements anhand der Formel einer binären Verbindung sollte man sich an der Regel orientieren: Die Gesamtwertigkeit aller Atome eines Elements muss gleich der Gesamtwertigkeit aller Atome eines anderen Elements sein.
Oxidationszustand Auch charakterisiert die Zusammensetzung des Stoffes und entspricht der stöchiometrischen Wertigkeit mit einem Pluszeichen (für ein Metall oder ein elektropositiveres Element im Molekül) oder einem Minuszeichen.
1. In einfachen Stoffen ist die Oxidationsstufe der Elemente Null.
2. Die Oxidationsstufe von Fluor in allen Verbindungen beträgt -1. Die übrigen Halogene (Chlor, Brom, Jod) mit Metallen, Wasserstoff und anderen elektropositiveren Elementen haben ebenfalls eine Oxidationsstufe von -1, in Verbindungen mit elektronegativeren Elementen haben sie jedoch positive Oxidationsstufen.
3. Sauerstoff in Verbindungen hat eine Oxidationsstufe von -2; Ausnahmen bilden Wasserstoffperoxid H 2 O 2 und seine Derivate (Na 2 O 2, BaO 2 usw., in denen Sauerstoff die Oxidationsstufe -1 hat, sowie Sauerstofffluorid OF 2, in dem die Oxidationsstufe von Sauerstoff vorliegt ist +2.
4. Alkalische Elemente (Li, Na, K usw.) und Elemente der Hauptnebengruppe der zweiten Gruppe des Periodensystems (Be, Mg, Ca usw.) haben immer eine Oxidationsstufe, die der Gruppennummer entspricht ist +1 bzw. +2.
5. Alle Elemente der dritten Gruppe, außer Thallium, haben eine konstante Oxidationsstufe, die der Gruppennummer entspricht, d.h. +3.
6. Die höchste Oxidationsstufe eines Elements entspricht der Gruppennummer des Periodensystems und die niedrigste ist die Differenz: Gruppennummer ist 8. Beispielsweise ist die höchste Oxidationsstufe von Stickstoff (es befindet sich in der fünften Gruppe) beträgt +5 (in Salpetersäure und ihren Salzen) und der niedrigste beträgt -3 (in Ammoniak und Ammoniumsalzen).
7. Die Oxidationsstufen der Elemente in einer Verbindung heben sich gegenseitig auf, sodass ihre Summe für alle Atome in einem Molekül oder einer neutralen Formeleinheit Null ist und für ein Ion seine Ladung.
Diese Regeln können verwendet werden, um die unbekannte Oxidationsstufe eines Elements in einer Verbindung zu bestimmen, wenn die Oxidationsstufen der anderen bekannt sind, und um Formeln für Verbindungen mit mehreren Elementen zu erstellen.
Oxidationszustand (Oxidationszahl) — ein konventioneller Hilfswert zur Aufzeichnung der Prozesse von Oxidations-, Reduktions- und Redoxreaktionen.
Konzept Oxidationszustand wird in der anorganischen Chemie häufig anstelle des Konzepts verwendet Wertigkeit. Der Oxidationszustand eines Atoms entspricht dem numerischen Wert der dem Atom zugeordneten elektrischen Ladung, vorausgesetzt, dass die bindenden Elektronenpaare vollständig auf elektronegativere Atome ausgerichtet sind (d. h. unter der Annahme, dass die Verbindung nur aus Ionen besteht).
Die Oxidationszahl entspricht der Anzahl an Elektronen, die einem positiven Ion hinzugefügt werden müssen, um es zu einem neutralen Atom zu reduzieren, oder von einem negativen Ion abgezogen werden müssen, um es zu einem neutralen Atom zu oxidieren:
Al 3+ + 3e − → Al
S 2− → S + 2e − (S 2− − 2e − → S)
Die Eigenschaften der Elemente variieren je nach Struktur der Elektronenhülle des Atoms je nach Perioden und Gruppen des Periodensystems. Da in einer Reihe analoger Elemente die elektronischen Strukturen nur ähnlich, aber nicht identisch sind, wird beim Übergang von einem Element in der Gruppe zu einem anderen für sie keine einfache Wiederholung der Eigenschaften beobachtet, sondern ihre mehr oder weniger deutlich zum Ausdruck kommende natürliche Veränderung .
Die chemische Natur eines Elements wird durch die Fähigkeit seines Atoms bestimmt, Elektronen abzugeben oder aufzunehmen. Diese Fähigkeit wird durch die Werte der Ionisierungsenergien und Elektronenaffinitäten quantifiziert.
Ionisierungsenergie (E und) ist die minimale Energiemenge, die für die Abstraktion und vollständige Entfernung eines Elektrons von einem Atom in der Gasphase bei T = 0 erforderlich ist
K ohne kinetische Energie auf das freigesetzte Elektron zu übertragen und dabei das Atom in ein positiv geladenes Ion umzuwandeln: E + Ei = E+ + e-. Die Ionisierungsenergie ist eine positive Größe und hat die niedrigsten Werte für Alkalimetallatome und die höchsten für Edelgasatome.
Elektronenaffinität (Ee) ist die Energie, die freigesetzt oder absorbiert wird, wenn einem Atom in der Gasphase bei T = 0 ein Elektron hinzugefügt wird
K mit der Umwandlung eines Atoms in ein negativ geladenes Ion, ohne kinetische Energie auf das Teilchen zu übertragen:
E + e- = E- + Ee.
Die Halogene, insbesondere Fluor, haben die maximale Elektronenaffinität (Ee = -328 kJ/mol).
Die Werte von Ei und Ee werden in Kilojoule pro Mol (kJ/mol) oder in Elektronenvolt pro Atom (eV) ausgedrückt.
Die Fähigkeit eines gebundenen Atoms, Elektronen chemischer Bindungen zu sich selbst zu verschieben und so die Elektronendichte um sich herum zu erhöhen, wird als bezeichnet Elektronegativität.
Dieses Konzept wurde von L. Pauling in die Wissenschaft eingeführt. Elektronegativitätwird mit dem Symbol ÷ bezeichnet und charakterisiert die Tendenz eines bestimmten Atoms, Elektronen hinzuzufügen, wenn es eine chemische Bindung eingeht.
Nach R. Maliken wird die Elektronegativität eines Atoms durch die Hälfte der Summe der Ionisierungsenergien und Elektronenaffinitäten freier Atome = (Ee + Ei)/2 geschätzt
In den Perioden besteht eine allgemeine Tendenz, dass die Ionisierungsenergie und die Elektronegativität mit zunehmender Ladung des Atomkerns in Gruppen ansteigen; diese Werte nehmen mit zunehmender Ordnungszahl des Elements ab.
Es sollte betont werden, dass einem Element kein konstanter Elektronegativitätswert zugeordnet werden kann, da dieser von vielen Faktoren abhängt, insbesondere vom Wertigkeitszustand des Elements, der Art der Verbindung, in der es enthalten ist, sowie der Anzahl und Art der benachbarten Atome .
Atom- und Ionenradien. Die Größe von Atomen und Ionen wird durch die Größe der Elektronenhülle bestimmt. Nach quantenmechanischen Konzepten hat die Elektronenhülle keine streng definierten Grenzen. Daher kann der Radius eines freien Atoms oder Ions angenommen werden als theoretisch berechneter Abstand vom Kern bis zur Position des Hauptmaximums der Dichte der äußeren Elektronenwolken. Dieser Abstand wird Umlaufradius genannt. In der Praxis werden üblicherweise die Radien von Atomen und Ionen in Verbindungen verwendet, die auf der Grundlage experimenteller Daten berechnet werden. Dabei werden kovalente und metallische Atomradien unterschieden.
Die Abhängigkeit der Atom- und Ionenradien von der Ladung des Atomkerns eines Elements ist periodischer Natur. In bestimmten Perioden neigen die Radien dazu, mit zunehmender Ordnungszahl abzunehmen. Der stärkste Rückgang ist typisch für Elemente kurzer Perioden, da deren äußeres elektronisches Niveau gefüllt ist. In großen Perioden in den Familien der D- und F-Elemente ist diese Änderung weniger stark, da in ihnen die Auffüllung mit Elektronen in der vorexternen Schicht erfolgt. In Untergruppen nehmen die Radien gleichartiger Atome und Ionen im Allgemeinen zu.
Das Periodensystem der Elemente ist ein anschauliches Beispiel für die Manifestation verschiedener Arten von Periodizität in den Eigenschaften von Elementen, die horizontal (in einer Periode von links nach rechts), vertikal (in einer Gruppe beispielsweise von oben nach unten) beobachtet wird ), diagonal, d.h. Einige Eigenschaften des Atoms nehmen zu oder ab, aber die Periodizität bleibt bestehen.
Im Zeitraum von links nach rechts (→) nehmen die oxidierenden und nichtmetallischen Eigenschaften der Elemente zu und die reduzierenden und metallischen Eigenschaften ab. Von allen Elementen der Periode 3 ist Natrium das aktivste Metall und das stärkste Reduktionsmittel und Chlor das stärkste Oxidationsmittel.
Chemische Bindung- Dies ist die gegenseitige Verbindung von Atomen in einem Molekül oder Kristallgitter durch die Wirkung elektrischer Anziehungskräfte zwischen den Atomen.
Hierbei handelt es sich um die Wechselwirkung aller Elektronen und aller Kerne, die zur Bildung eines stabilen, mehratomigen Systems (Radikal, Molekülion, Molekül, Kristall) führt.
Chemische Bindungen werden durch Valenzelektronen hergestellt. Nach modernen Vorstellungen ist eine chemische Bindung elektronischer Natur, erfolgt jedoch auf unterschiedliche Weise. Daher gibt es drei Haupttypen chemischer Bindungen: kovalent, ionisch, metallisch.Entsteht zwischen Molekülen Wasserstoffverbindung, und geschehen Van-der-Waals-Wechselwirkungen.
Zu den Hauptmerkmalen einer chemischen Bindung gehören:
- Verbindungslänge - Dies ist der Kernabstand zwischen chemisch gebundenen Atomen.
Dies hängt von der Art der interagierenden Atome und der Vielfalt der Bindung ab. Mit zunehmender Multiplizität nimmt die Bindungslänge ab und damit ihre Festigkeit zu;
- Die Multiplizität der Bindung wird durch die Anzahl der Elektronenpaare bestimmt, die zwei Atome verbinden. Mit zunehmender Multiplizität nimmt die Bindungsenergie zu;
- Verbindungswinkel- der Winkel zwischen imaginären Geraden, die durch die Kerne zweier chemisch miteinander verbundener benachbarter Atome verlaufen;
Bindungsenergie E SV - Dabei handelt es sich um die Energie, die bei der Bildung einer bestimmten Bindung freigesetzt und für deren Bruch aufgewendet wird, kJ/mol.
Kovalente Bindung - Eine chemische Bindung, die durch die gemeinsame Nutzung eines Elektronenpaares zwischen zwei Atomen entsteht.
Die Erklärung der chemischen Bindung durch die Entstehung gemeinsamer Elektronenpaare zwischen Atomen bildete die Grundlage der Spintheorie der Valenz, deren Werkzeug ist Valenzbindungsmethode (MVS) , 1916 von Lewis entdeckt. Für eine quantenmechanische Beschreibung chemischer Bindungen und der Struktur von Molekülen wird eine andere Methode verwendet – Molekülorbitalmethode (MMO) .
Valenzbindungsmethode
Grundprinzipien der chemischen Bindungsbildung mittels MBC:
1. Eine chemische Bindung wird durch Valenzelektronen (ungepaarte) gebildet.
2. Elektronen mit antiparallelem Spin, die zu zwei verschiedenen Atomen gehören, werden gemeinsam.
3. Eine chemische Bindung entsteht nur, wenn bei der Annäherung zweier oder mehrerer Atome einander die Gesamtenergie des Systems abnimmt.
4. Die Hauptkräfte, die in einem Molekül wirken, sind elektrischen Coulomb-Ursprungs.
5. Je stärker die Verbindung, desto stärker überlappen sich die wechselwirkenden Elektronenwolken.
Es gibt zwei Mechanismen für die Bildung kovalenter Bindungen:
Austauschmechanismus. Eine Bindung entsteht durch die gemeinsame Nutzung der Valenzelektronen zweier neutraler Atome. Jedes Atom trägt ein ungepaartes Elektron zu einem gemeinsamen Elektronenpaar bei:
Reis. 7. Austauschmechanismus zur Bildung kovalenter Bindungen: A- unpolar; B- polar
Donor-Akzeptor-Mechanismus. Ein Atom (Donor) stellt ein Elektronenpaar bereit, und das andere Atom (Akzeptor) stellt ein leeres Orbital für dieses Paar bereit.
Verbindungen, gebildet gehören nach dem Donor-Akzeptor-Mechanismus dazu komplexe Verbindungen
Reis. 8. Donor-Akzeptor-Mechanismus der Bildung kovalenter Bindungen
Eine kovalente Bindung hat bestimmte Eigenschaften.
Sättigungsfähigkeit - die Eigenschaft von Atomen, eine genau definierte Anzahl kovalenter Bindungen zu bilden. Aufgrund der Bindungssättigung haben Moleküle eine bestimmte Zusammensetzung.
|
Richtwirkung - t . h. die Verbindung entsteht in Richtung der maximalen Überlappung der Elektronenwolken . In Bezug auf die Linie, die die Zentren der die Bindung bildenden Atome verbindet, werden unterschieden: σ und π (Abb. 9): σ-Bindung – gebildet durch Überlappung von AO entlang der Linie, die die Zentren der interagierenden Atome verbindet; Eine π-Bindung ist eine Bindung, die in Richtung einer Achse senkrecht zur Verbindungslinie zwischen den Atomkernen auftritt. Die Richtung der Bindung bestimmt die räumliche Struktur der Moleküle, also ihre geometrische Form. Hybridisierung - Dabei handelt es sich um eine Formänderung einiger Orbitale bei der Bildung einer kovalenten Bindung, um eine effizientere Orbitalüberlappung zu erreichen. Die unter Beteiligung von Elektronen hybrider Orbitale gebildete chemische Bindung ist stärker als die Bindung unter Beteiligung von Elektronen nichthybrider s- und p-Orbitale, da mehr Überlappungen auftreten. Folgende Hybridisierungsarten werden unterschieden (Abb. 10, Tabelle 31): sp-Hybridisierung - Ein s-Orbital und ein p-Orbital verwandeln sich in zwei identische „hybride“ Orbitale, der Winkel zwischen ihren Achsen beträgt 180°. Die Moleküle, in denen die sp-Hybridisierung stattfindet, haben eine lineare Geometrie (BeCl 2). |
sp 2-Hybridisierung- Ein s-Orbital und zwei p-Orbitale verwandeln sich in drei identische „hybride“ Orbitale, der Winkel zwischen ihren Achsen beträgt 120°. Moleküle, in denen eine sp 2 -Hybridisierung stattfindet, haben eine flache Geometrie (BF 3, AlCl 3).
S. 3-Hybridisierung- Ein s-Orbital und drei p-Orbitale verwandeln sich in vier identische „Hybrid“-Orbitale, deren Achsenwinkel 109°28“ beträgt. Moleküle, in denen eine sp 3 -Hybridisierung stattfindet, haben eine tetraedrische Geometrie (CH 4). , NH3).
Reis. 10. Arten der Hybridisierung von Valenzorbitalen: a - sp-Hybridisierung von Valenzorbitalen; B - sp 2 - Hybridisierung von Valenzorbitalen; V - sp 3-Hybridisierung von Valenzorbitalen